题目内容
6.由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4$→_{800℃,Ar}^{Mg}$Ti已知:①C(s)+O2(g)═CO2(g);△H=-393.4KJ/mol
②2CO(g)+O2(g)═2CO2(g);△H=-556KJ/mol
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141KJ/mol
则:TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO2(g);△H=-80KJ/mol.
分析 由①C(s)+O2(g)═CO2(g)△H=-393.4KJ/mol,
②2CO(g)+O2(g)═2CO2(g)△H=-556KJ/mol,
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141KJ/mol,
结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),以此来解答.
解答 解:由①C(s)+O2(g)═CO2(g)△H=-393.4KJ/mol,
②2CO(g)+O2(g)═2CO2(g)△H=-556KJ/mol,
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141KJ/mol,
结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),
所以△H=+141KJ/mol+(-393.5KJ/mol)×2+566KJ/mol=-80KJ/mol,
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol,
故答案为:-80KJ/mol.
点评 本题考查盖斯定律计算反应热,为高频考点,把握已知反应与目标反应的关系为解答的关键,注意反应的加和关系与反应热的加和关系相对应,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
16.下列物质不可能含有离子键的是( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
11.如图各装置不能达到实验目的是( )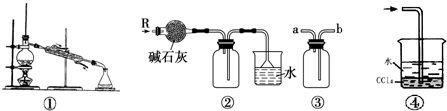

| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
18.下列溶液中的Cl-与50mL 1mol/L MgCl2溶液中的Cl- 物质的量相等的是( )
| A. | 50mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L CaCl2溶液 | ||
| C. | 50mL 2 mol/L KCl溶液 | D. | 75 mL 1 mol/L AlCl3溶液 |
15.除去溴苯中少量溴的方法是( )
| A. | 加入苯使之反应 | B. | 加入KI溶液 | ||
| C. | 加入较大量NaOH溶液后静置分液 | D. | 加入较大量的CCl4萃取静置后分液 |
16.用NA表示阿伏伽德罗常数.下列叙述不正确的是( )
| A. | 由二氧化碳和氧气组成的混合气体共有NA个分子,其中氧原子数为2NA | |
| B. | 1mol铜与足量稀硝酸反应可产生NO分子$\frac{2}{3}$NA个. | |
| C. | 12g金刚石中含有共价键数为4NA | |
| D. | 1L1mol/L硫酸铝溶液中阴阳离子总数大于5NA. |
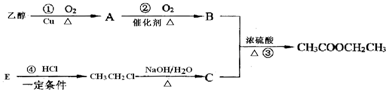
 ;
;