题目内容
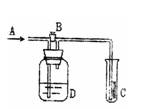
(7分)一定量的氢气在氯气中燃烧,所得混合物用100mL 4.00mol/L的NaOH溶液(密度为1.20g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0. 0800mol。(以下计算要有计算过程)
(1)求原NaOH溶液的质量分数为多少?
(2)求所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比为多少?
(1)求原NaOH溶液的质量分数为多少?
(2)求所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比为多少?
解:(1)(2分)n(NaOH)=0.1L×4.00mol/L=0.4mol
w(NaOH)=0.4mol×40g/mol÷(100ml×1.20g/mL) ×100%≈13.3%
(2) (2分)由钠守恒可知,溶液中
n(NaOH)=n(NaCl) +n(NaClO)
n(Cl-)=0.4mol-0.0800mol=0.32mol
(3)(3分) Cl2+H2="2HCl " Cl2+2NaOH=" NaCl+" NaClO+H2O
由反应方程式可知:与NaOH反应的氯气为0.08mol,该反应生成的NaCl为0.08mol,因此氢气燃烧产生氯化氢为0.24mol,则氢气为0.12mol.总的氯气为0.20mol。所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=5︰3
w(NaOH)=0.4mol×40g/mol÷(100ml×1.20g/mL) ×100%≈13.3%
(2) (2分)由钠守恒可知,溶液中
n(NaOH)=n(NaCl) +n(NaClO)
n(Cl-)=0.4mol-0.0800mol=0.32mol
(3)(3分) Cl2+H2="2HCl " Cl2+2NaOH=" NaCl+" NaClO+H2O
由反应方程式可知:与NaOH反应的氯气为0.08mol,该反应生成的NaCl为0.08mol,因此氢气燃烧产生氯化氢为0.24mol,则氢气为0.12mol.总的氯气为0.20mol。所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=5︰3
略

练习册系列答案
相关题目
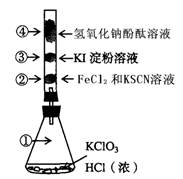
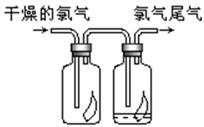

 CO2+H2
CO2+H2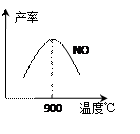 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应: