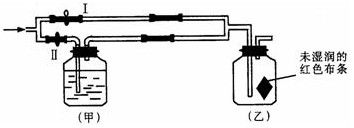
题目内容
将4.66g卤素互化物BrClx溶于水后,通入足量SO2气体与其反应生成氢溴酸、盐酸和硫酸,再用碱将溶液调至中性后,加入过量Ba(NO3)2溶液,充分反应后滤去沉淀物,再向滤液中加入过量AgNO3溶液,最后得卤化银沉淀15.46g。试计算:
(1)参加反应的AgNO3的物质的量。
(2)BrClx中的x值。
(1)参加反应的AgNO3的物质的量。
(2)BrClx中的x值。
0.1 mol;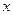 =3
=3
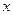 =3
=3质量增加的是Ag的质量
所以n(AgNO3)= ="0.1" (mol)
="0.1" (mol)
设4.66g卤素互化物BrClx为a mol
BrClx → AgBr + xAgCl 质量增加
1mol 108(1+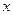 )
)
a mol 15.46g-4.66g
则: a=
a=
所以: =
=
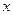 =3
=3
所以n(AgNO3)=
 ="0.1" (mol)
="0.1" (mol)设4.66g卤素互化物BrClx为a mol
BrClx → AgBr + xAgCl 质量增加
1mol 108(1+
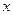 )
)a mol 15.46g-4.66g
则:
 a=
a=
所以:
 =
=
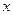 =3
=3
练习册系列答案
相关题目

 HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。