题目内容
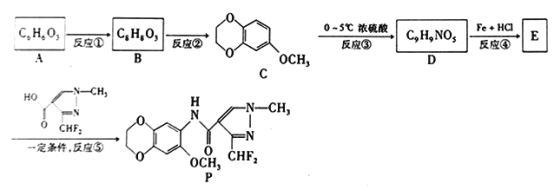
【题目】某金属A及其化合物之间有如下的转化关系:
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
【答案】 Fe FeCl3 Fe+2FeCl3=3FeCl2 Fe3++3OH- =Fe(OH)3 ↓ 4Fe(OH)2+O2+H2O=4 Fe(OH)3
【解析】红褐色C为Fe(OH)3,根据元素守恒可知金属A是Fe,Fe在氯气中燃烧生成B为FeCl3,Fe和HCl反应生成FeCl2和H2,FeCl3和Fe反应生成FeCl2,则D为FeCl2,B和NaOH反应生成红褐色的C为Fe(OH)3,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成Fe(OH)3。
(1)通过以上分析知,A是Fe、B为FeCl3,故答案为:Fe;FeCl3;
(2)B→D的反应为FeCl3和Fe反应生成FeCl2,化学方程式为Fe+2FeCl3=3FeCl2,故答案为:Fe+2FeCl3=3FeCl2;
(3)氯化铁与氢氧化钠反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3OH- =Fe(OH)3 ↓,故答案为:Fe3++3OH- =Fe(OH)3 ↓;
(4)E→C的反应为氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2═4Fe(OH)3。

 阅读快车系列答案
阅读快车系列答案【题目】I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________。
(2)元素周期表中位于第8纵行的铁元素属于_________族。
(3)元素周期表中最活泼的非金属元素位于第_________纵行。
(4)所含元素超过18种的周期是第_________周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
(1)元素x在周期表中的位置是第________周期、第________族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____,碱性最强的是_____(填化学式)。