��Ŀ����
����ͼװ�ý���SO2ת��ΪSO3��ת���ʲⶨʵ�飺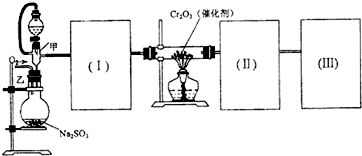
2SO2+O2
| Cl2O2 |
| �۵㣨�棩 | �е㣨�棩 | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
��2����װ�����Ӻã�ʵ��ǰ��������еIJ����ǣ�����д������̣�
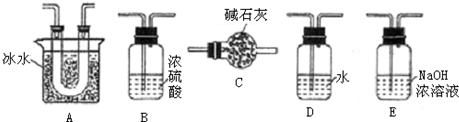
��3��ʵ��ʱ��Ũ������˳��������ƿ�У���װ�������������
��4����ʼʵ��ʱ���ȴ��Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ����Ũ��������ȴ������Ⱥ�˳����
��5��ʵ���С���Cr2O3�������ʱ��Ӧ���ƾ����ƿ�һ����ټ��ȡ����Է��¶ȹ��ߣ���������ԭ����
��6��ʵ��ʱ����25.2g��Na2SO3�������Ũ�����������ģ���Ӧ����ʱ����ͨ��O2һ��ʱ�䣬�Ƶâ�װ�õ���������11.3g����ʵ����SO2��ת����Ϊ
��������1��������Ũ��������������������壻SO3���۵���16��8�棬�ϵͣ������ñ�ˮ���������������Ϊ��ˮ��β��������
��2��������Ʊ�������ʵ������Ҫ���װ�õ������ԣ�
��3������ѹǿʹҺ��˳�����£�75%��Ũ��������ƶ���������ܽ⣻
��4���ȼ��ȴ����ٵ���Ũ���ᣬ�ܱ�֤�����Ķ��������ܶ��ת��Ϊ��������
��5����ӦΪ���ȷ�Ӧ���Ҵ����ڸ���������ɥʧ�����ԣ�
��6������Na2SO3��SO2��SO3��ϵʽ�����м��㣮
��2��������Ʊ�������ʵ������Ҫ���װ�õ������ԣ�
��3������ѹǿʹҺ��˳�����£�75%��Ũ��������ƶ���������ܽ⣻
��4���ȼ��ȴ����ٵ���Ũ���ᣬ�ܱ�֤�����Ķ��������ܶ��ת��Ϊ��������
��5����ӦΪ���ȷ�Ӧ���Ҵ����ڸ���������ɥʧ�����ԣ�
��6������Na2SO3��SO2��SO3��ϵʽ�����м��㣮
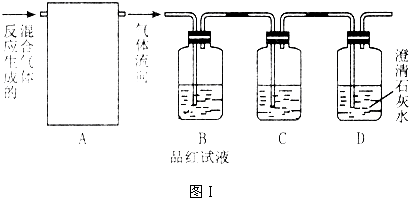
����⣺��1����װ�ñ���Ҫ�Զ���������и��������Ũ��������������������壻SO3���۵���16��8�棬�����ñ�ˮ�������������δ��Ӧ���Ķ�������Կ����������Ⱦ�����м�Ũ���������װ�ü�����������Һβ������װ�ã��ʴ�Ϊ��B��A��BE��
��2��ʵ��ǰ��������еIJ����Ǽ��װ�õ������ԣ��ʴ�Ϊ�����װ�õ������ԣ�
��3��ΪʹҺ��˳�����£����װ������������DZ��ַ�Һ©����ѹǿ����ƿ��ѹǿ��ȣ�ʵ����Ҫ��75%��Ũ���������ϡ�����Ʊ�SO2��ԭ���Ƕ���������ˮ���ܽ�ȣ����³�ѹ1��40������Ũ��Խ�����������������У��Ӷ������ڶ��������ݳ���
�ʴ�Ϊ�����ַ�Һ©����ѹǿ����ƿ��ѹǿ��ȣ�����������ˮ���ܽ�ȣ����³�ѹ1��40������Ũ��Խ�����������������У��Ӷ������ڶ��������ݳ���
��4��Ϊ��֤�����Ķ��������ܶ��ת��Ϊ��������Ӧ�ȼ��ȴ����ٵ���Ũ���ᣬ
�ʴ�Ϊ���ȼ��ȴ����ٵ���Ũ���
��5���Է��¶ȹ��ߣ���������ԭ�����¶ȹ��߲����ö�����������ɣ���Ӱ������Ļ��ԣ��ʴ�Ϊ���¶ȹ��߲����ö�����������ɣ���Ӱ������Ļ��ԣ�
��6������ԭ���غ��֪��Na2SO3��SO2��SO3��n��Na2SO3��=0.2mol��������n��SO3��=0.2mol��������Ϊ0.2mol��80g/mol=16g���Ƶâ�װ�õ���������11.3g��SO2��ת����Ϊ
��100%=70.6%���ʴ�Ϊ��70.6��
��2��ʵ��ǰ��������еIJ����Ǽ��װ�õ������ԣ��ʴ�Ϊ�����װ�õ������ԣ�
��3��ΪʹҺ��˳�����£����װ������������DZ��ַ�Һ©����ѹǿ����ƿ��ѹǿ��ȣ�ʵ����Ҫ��75%��Ũ���������ϡ�����Ʊ�SO2��ԭ���Ƕ���������ˮ���ܽ�ȣ����³�ѹ1��40������Ũ��Խ�����������������У��Ӷ������ڶ��������ݳ���
�ʴ�Ϊ�����ַ�Һ©����ѹǿ����ƿ��ѹǿ��ȣ�����������ˮ���ܽ�ȣ����³�ѹ1��40������Ũ��Խ�����������������У��Ӷ������ڶ��������ݳ���
��4��Ϊ��֤�����Ķ��������ܶ��ת��Ϊ��������Ӧ�ȼ��ȴ����ٵ���Ũ���ᣬ
�ʴ�Ϊ���ȼ��ȴ����ٵ���Ũ���
��5���Է��¶ȹ��ߣ���������ԭ�����¶ȹ��߲����ö�����������ɣ���Ӱ������Ļ��ԣ��ʴ�Ϊ���¶ȹ��߲����ö�����������ɣ���Ӱ������Ļ��ԣ�
��6������ԭ���غ��֪��Na2SO3��SO2��SO3��n��Na2SO3��=0.2mol��������n��SO3��=0.2mol��������Ϊ0.2mol��80g/mol=16g���Ƶâ�װ�õ���������11.3g��SO2��ת����Ϊ
| 11.3g |
| 16g |
���������⿼�������������ʡ������Լ����ӵļ����֪ʶ���ۺ��Խ�ǿ����Ŀ�ѶȽϴ���ѧ�������ͽ�����������������ʵ�鼰���������Ŀ��飮

��ϰ��ϵ�д�
�����Ŀ
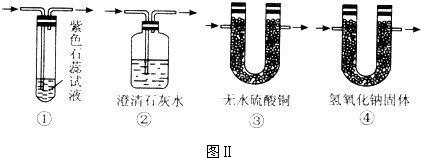
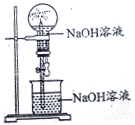 ���и����е����嶼������ͼװ�ý�����Ȫʵ����ǣ�������
���и����е����嶼������ͼװ�ý�����Ȫʵ����ǣ�������| A��HCl��CO | B��SO2��CO2 | C��NH3��CH4 | D��O2��NO |
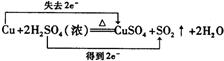
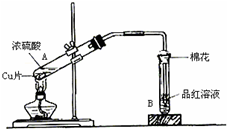 ����ͼװ�ý���ͭ��һ�������֪Ũ�ȵ�Ũ���ᷴӦ��ʵ���о���
����ͼװ�ý���ͭ��һ�������֪Ũ�ȵ�Ũ���ᷴӦ��ʵ���о���