题目内容
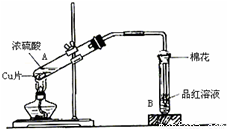
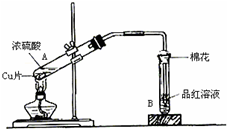 用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.(1)写出试管B中的实验现象
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目:

(3)充分反应后,该学生发现铜和硫酸都有剩余.在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种不是酸类的物质)
(4)B试管口的棉花应沾有的试剂是
(2)铜和热的浓硫酸反应生成二氧化硫、硫酸铜和水;
(3)加氧化性与稀硫酸在同一溶液,能氧化铜单质;
(4)铜和热的浓硫酸反应,生成的B试管中的物质为二氧化硫,二氧化硫为大气污染物.
| ||
(2)铜和热的浓硫酸反应生成二氧化硫、硫酸铜和水;铜的化合价升高2价失去两个电子,硫酸中硫的化合价降低2价得到两个电子,
故答案为:
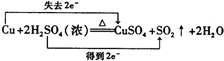 ;
;(3)铜和浓硫酸反应时,当硫酸稀到一定程度时,该反应停止,可以加入氧化剂,铜能继续溶解,如NaNO3与稀硫酸在同一溶液相当于稀硝酸,稀硝酸能和铜单质在常温下反应,Fe2O3溶于稀硫酸生成氧化性的三价铁能和铜反应,FeCl3中具有氧化性的三价铁能和铜反应,故答案为:NaNO3、Fe2O3、FeCl3等;
(4)SO2是酸性氧化物,也是大气污染物,所以应该用NaOH溶液吸收,氢氧化钠和 二氧化硫反应生成亚硫酸钠和水,反应的离子方程式为:2OH-+SO2=SO32-+H2O,
故答案为:NaOH溶液;吸收尾气,防止污染;2OH-+SO2=SO32-+H2O.

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案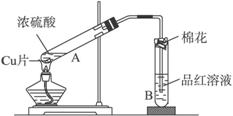
(1)写出A、B两试管中的实验现象:
A__________________________________、__________________________________(两种即可);B__________________________________。
(2)充分反应后,发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若使剩余铜片溶解,可再加入物质的化学式为____________________。
(3)测定剩余硫酸的物质的量时,先测铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量。他认为测定SO2的量的方法有多种,下列方案中不可行的是( )
A.将A产生的气体干燥后缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称量
B.将A产生的气体缓缓通入稀硫酸酸化的KMnO4溶液,加足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.将A产生的气体缓缓通入足量用HNO3酸化的Ba(NO3)2溶液,充分反应过滤、洗涤、干燥、称量沉淀
D.用排饱和NaHSO3溶液的方法测出干燥后装置A产生SO2气体的体积(已折算成标准状况)
(4)向反应后的溶液中加入足量的氧化铜,使剩余的硫酸转化为硫酸铜,过滤后将滤液加热浓缩,冷却制得硫酸铜晶体(CuSO4·xH2O),用加热法测定该晶体里结晶水x的值。其中一次实验的数据为:
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.7 | G | 11.7 |
根据数据计算,判断x的实测值比理论值(x=5)_________(填“偏大”或“偏小”),实验中产生误差的原因可能是_________(填字母编号)。
A.硫酸铜晶体中含有不挥发杂质
B.加热失水后露置在空气中冷却
C.加热时有晶体飞溅出去
D.硫酸铜晶体(CuSO4·xH2O)在称量前晶体的表面吸收了水分

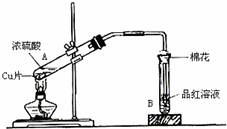 用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.