题目内容
(2009?肇庆一模)用如图装置进行实验,请回答下列问题:
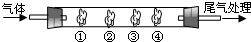
I.(1)若通入SO2气体,请填写表中空格:
(2)写出③中反应的离子方程式:
II.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿某固体物质、②浸有KI溶液、③浸有石蕊溶液、④浸有浓NaOH溶液.请回答:
(1)观察到②处棕黄色物质产生,则:①处包有的某固体物质可能是下列的
a.MnO2 b.KMnO4 c.KCl d.Cu
(2)在实验过程中,在③处能观察到
(3)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,该反应的离子方程式为

I.(1)若通入SO2气体,请填写表中空格:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 棉花浸取试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
I2+SO2+2H2O=SO42-+4H++2I-
I2+SO2+2H2O=SO42-+4H++2I-
II.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿某固体物质、②浸有KI溶液、③浸有石蕊溶液、④浸有浓NaOH溶液.请回答:
(1)观察到②处棕黄色物质产生,则:①处包有的某固体物质可能是下列的
b
b
(填下面物质的序号),其反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
.a.MnO2 b.KMnO4 c.KCl d.Cu
(2)在实验过程中,在③处能观察到
先变红后褪色
先变红后褪色
.(3)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,该反应的离子方程式为
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
.分析:Ⅰ.(1)二氧化硫溶于水生成亚硫酸,溶于呈酸性,二氧化硫有漂白性和还原性,据此分析.
(2)碘有氧化性,二氧化硫有还原性,二氧化硫和碘能发生氧化还原反应,写出相应的离子方程式.
Ⅱ.(1)氯化氢和碘化钾不反应,但氯化氢有还原性,能被强氧化剂氧化生成氯气,所以应选取强氧化剂,能把氯化氢氧化成氯气,再利用氯气的性质检验其它物质.
(2)石蕊试液遇酸显红色,但次氯酸有漂白性,能使石蕊试液褪色.
(3)氯气有强氧化性,能氧化碘生成碘酸根离子.
(2)碘有氧化性,二氧化硫有还原性,二氧化硫和碘能发生氧化还原反应,写出相应的离子方程式.
Ⅱ.(1)氯化氢和碘化钾不反应,但氯化氢有还原性,能被强氧化剂氧化生成氯气,所以应选取强氧化剂,能把氯化氢氧化成氯气,再利用氯气的性质检验其它物质.
(2)石蕊试液遇酸显红色,但次氯酸有漂白性,能使石蕊试液褪色.
(3)氯气有强氧化性,能氧化碘生成碘酸根离子.
解答:解:I.(1)①二氧化硫能和水反应生成亚硫酸,亚硫酸能电离出氢离子使溶液呈酸性,石蕊试液遇酸变红色.
故答案为:变红.
②二氧化硫有漂白性,能使品红溶液褪色.
故答案为:褪色.
③二氧化硫有还原性,碘有氧化性,二氧化硫和碘能发生氧化还原反应而使淀粉和碘水混合液褪色.
故答案为:还原性.
(2)二氧化硫能和碘发生氧化还原反应生成硫酸和氢碘酸,离子方程式为I2+SO2+2H2O=SO42-+4H++2I-.
故答案为:I2+SO2+2H2O=SO42-+4H++2I-.
Ⅱ.(1)氯化氢和碘化钾不反应,但氯化氢有还原性,能被强氧化剂氧化生成氯气,所以应选取强氧化剂,能把氯化氢氧化成氯气,具有强氧化性的物质只有高锰酸钾;发生的离子方程式为:
2MnO4-+10Cl-+16H+=2Mn2++5 Cl2↑+8H2O.
故答案为:b; 2MnO4-+10Cl-+16H+=2Mn2++5 Cl2↑+8H2O
(2)氯气和水反应生成盐酸和次氯酸,所以溶液呈酸性,石蕊试液遇酸显红色;次氯酸有漂白性,而使溶液褪色,所以看到的现象是先变红后褪色.
故答案为:先变红后褪色.
(3)氯气有氧化性,碘有还原性,氯气能把碘氧化为碘酸同时生成盐酸,
离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:变红.
②二氧化硫有漂白性,能使品红溶液褪色.
故答案为:褪色.
③二氧化硫有还原性,碘有氧化性,二氧化硫和碘能发生氧化还原反应而使淀粉和碘水混合液褪色.
故答案为:还原性.
(2)二氧化硫能和碘发生氧化还原反应生成硫酸和氢碘酸,离子方程式为I2+SO2+2H2O=SO42-+4H++2I-.
故答案为:I2+SO2+2H2O=SO42-+4H++2I-.
Ⅱ.(1)氯化氢和碘化钾不反应,但氯化氢有还原性,能被强氧化剂氧化生成氯气,所以应选取强氧化剂,能把氯化氢氧化成氯气,具有强氧化性的物质只有高锰酸钾;发生的离子方程式为:
2MnO4-+10Cl-+16H+=2Mn2++5 Cl2↑+8H2O.
故答案为:b; 2MnO4-+10Cl-+16H+=2Mn2++5 Cl2↑+8H2O
(2)氯气和水反应生成盐酸和次氯酸,所以溶液呈酸性,石蕊试液遇酸显红色;次氯酸有漂白性,而使溶液褪色,所以看到的现象是先变红后褪色.
故答案为:先变红后褪色.
(3)氯气有氧化性,碘有还原性,氯气能把碘氧化为碘酸同时生成盐酸,
离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
点评:本题考查了二氧化硫和氯气的性质,难度不大,明确二氧化硫和次氯酸漂白性的区别.

练习册系列答案
相关题目
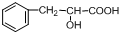 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下: