题目内容
【题目】(1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式 。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
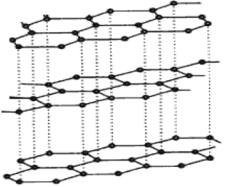
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 杂化与周围碳原子成键。
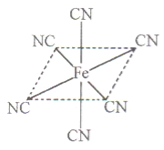
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中![]() 键数目为 。
键数目为 。
②上述沉淀溶解过程的化学方程式为 。
【答案】(10分)(1)[CoCl2(NH3)4]Cl(2)Fe3O4(3)sp2 (4)①2NA
② ![]() (各2分)
(各2分)
【解析】
试题(1)1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,这说明该配位化合物中有1个氯离子不是配体。又因为Cr是+3价的,则氯原子的购书是3个,由于配位数是6,所以化学式应该是[CoCl2(NH3)4]Cl。
(2)根据核外电子排布式可知,离子型氧化物MnO2和Fe3O4及Cr2O3中金属阳离子含有的未成对电子分别是3、14/3、3,所以磁性最大的Fe3O4。
(3)石墨是层状结构,所以每个碳原子通过sp2杂化与周围碳原子成键。
①CN—与N2结构相似,氮气中含有三键,有2个![]() 键,所以1molCN-中
键,所以1molCN-中![]() 键数目为2NA。
键数目为2NA。
②根据结构式可知,分子中含有配位健,且配位数是6,所以沉淀溶解过程的化学方程式为Fe(CN)2+4KCN=K4Fe(CN)6。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案