题目内容
【题目】在一密闭容器中加入等物质的量的A、B,发生如下反应:2A(g)+2B(g) ![]() 3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
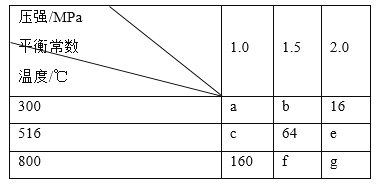
下列判断正确的是( )
A.g>f
B.ΔH<0
C.2.0MPa、800℃时,A的转化率最小
D.1.5MPa、300℃时,B的转化率为50%
【答案】D
【解析】
A. 一个指定反应的平衡常数只受温度的影响,所以图表中g=f=160,故A错误;
B. 300℃时该反应的平衡常数是16,516℃时,该反应的平衡常数为64,说明升温时平衡向右移动,该反应属于吸热反应,ΔH>0,故B错误;
C. 800℃时,上述实验条件的平衡常数最大,且该反应前后气体分子总数不变,压强改变对平衡无影响,所以,2.0MPa、800℃时,A的转化率最大。故C错误;
D. 300℃时该反应的平衡常数是16,设开始时A、B的浓度均为1mol/L,达到平衡是A减少了xmol/L
2A(g)+2B(g) ![]() 3C(s)+4D(g)
3C(s)+4D(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) x x 2x
平衡浓度(mol/L) 1-x 1-x 2x
![]() ,x=0.5,所以B的转化率为50%,故D正确;
,x=0.5,所以B的转化率为50%,故D正确;
故选D。

练习册系列答案
相关题目