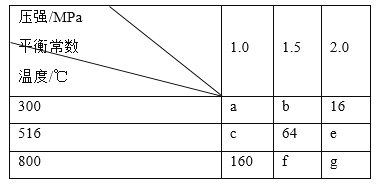
题目内容
【题目】为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是

A.正极的电极方程式为:O2 + 2H2O + 4e_=4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
【答案】D
【解析】
A、钢铁的吸氧腐蚀中,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A正确;
B、将石墨换成镁,镁和铁构成的原电池中,镁作负极,容易失去电子被氧化,所以铁被保护而不易生锈,故B正确;
C、向自来水中加入少量氯化钠固体,溶液中自由移动离子增加,铁失电子能力增加,所以可以较快看到铁锈,故C正确;
D、钢铁的吸氧腐蚀中,铁失去电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,溶液中亚铁离子向正极移动,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得慢,故D错误;
故选D。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
I.探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2![]() 2Fe2O3+8FeCl3,4FeCl2+3O2
2Fe2O3+8FeCl3,4FeCl2+3O2![]() 2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。

(1)实验装置的合理连接顺序为:A→__________→D,装置E的作用是___________。
(2)D中发生反应的离子方程式_______。
(3)某化学兴趣小组在控制在500℃下发生反应,一段时间后的产物进行了如下实验探究:
①对B中反应剩余固体的成分开展实验探究,并作出以下两种假设:
假设一:产物为Fe2O3;
假设二:产物为________(填化学式)。
以下针对上述假设一,展开实验研究,请完善下面表格:
实验操作 | 预期现象与结论 |
取少量固体样品于一支洁净的试管中,加入足量的蒸馏水。 | ______,则假设一成立,否则,假设一不成立。 |
②对固体产物(标准状况下)成分含量进行了如下实验探究:B中反应剩余固体的质量经测定为m1g ,E中生成物的质量经测定为m2g。B中反应剩余固体按探究①的实验步骤进行操作,并最终得到干燥纯净的固体质量为m3g。则固体产物中Fe2O3所占的质量分数为______。
Ⅱ.卤素化合物之间反应实验条件控制探究
(4)室温下,KClO3可将KI氧化为I2或KIO3。下面是该小组设计的一组实验数据记录表:
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1KI溶液/ mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4溶液/ mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
反应完全后,滴加2滴淀粉溶液 | 无色 | 蓝色 | 蓝色较2浅 | 无色 |
①根据实验数据,结合所学化学知识,下列说法正确的是______
A.该实验目的是探究其它条件相同时,酸的浓度对反应产物的影响
B.实验1和实验4说明硫酸浓度太低或太浓,KClO3与KI均不反应
C.实验2的现象说明在该硫酸浓度下KClO3将KI氧化为I2
D.实验3蓝色较2浅的原因是在该硫酸浓度下淀粉部分水解
②2号试管反应完全后,假设还原产物只有KC1,写出反应的离子方程式___________。