题目内容
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2两种离子化合物。
(1)写出Y2O和Y2O2的电子式:_______________________、________________________,其中后者含有的化学键是______________(填“离子键”、“极性键”或“非极性键”);
(2)XH3、H2Z和HW三种化合物,沸点最高的是____________(填化学式);
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是_________(填化学式);
(4)用电子式表示Y2O的形成过程______________________________________________。
【答案】 ![]()
![]() 离子键、非极性键 NH3 HClO4
离子键、非极性键 NH3 HClO4 ![]()
【解析】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,则X、Z、W分别为第VA、VIA、VIIA族元素;Y与氧元素可组成Y2O和Y2O2两种离子化合物,则Y为Na元素,X、Z、W分别为N、S、Cl元素。
(1)Na2O和Na2O2的电子式分别为![]() 、
、![]() ,其中过氧化钠含有的化学键是离子键、非极性键;
,其中过氧化钠含有的化学键是离子键、非极性键;
(2)NH3、H2S和HCl三种化合物,因为NH3分子之间可以形成氢键,所以沸点最高的是NH3;
(3)N、S、Cl三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4;
(4)用电子式表示Na2O的形成过程为:![]() 。
。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2 , 含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):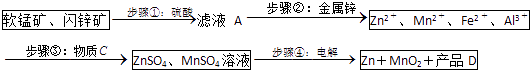
已知各种金属离子完全沉淀的pH如表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:、 .
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2 , 其作用是 , 另外一种固体物质可为 .
(4)步骤④中电解过程中MnO2在极析出,该电极上发生的反应方程式为产品D的化学式为 , 该物质对整个生产的意义是 .