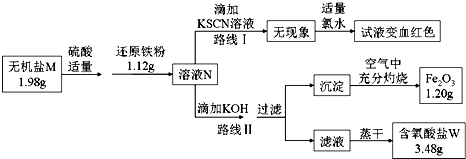
��Ŀ����
����Ŀ��MnO2��п������ɵ�ص���Ҫԭ�ϣ���ⷨ����MnO2��ͳ�Ĺ�����Ҫ����Ϊ�����̿��ú��ԭ���գ���������������ϣ�����Һ����Ҫ��Mn2+�����������ٽ��е�⣬MnO2�ڵ��ص�����������90������ڷ���������MnO2��п���¹��գ���Ҫ�Dz������̿���Ҫ�ɷ�ΪMnO2 �� ������Al2O3��SiO2���ʣ�����п����Ҫ�ɷ�ΪZnS��������FeS��CuS��CdS���ʣ�Ϊ��Ҫԭ�ϣ��������Ӻõ���Zn2+��Mn2+���ӵ���Һ����ͨ�����ͬʱ���MnO2��п�������̿�ͼ��ͼ���м����Ĺ��岿���Ѿ���ȥ����
��֪���ֽ���������ȫ������pH�����
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1��������У����̿���п�����������Һ����ʱ������ķ�ӦΪ������ԭ��Ӧ�����磺MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S��+2H2O����д��MnO2��������Һ�зֱ��CuS��FeS������Ӧ�Ļ�ѧ����ʽ���� ��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ�Ϊ���û�ѧ���ű�ʾ��
��3�����������C�ɶ���������ɣ����к������ֹ��壬����һ��ΪMnO2 �� �������� �� ����һ�ֹ������ʿ�Ϊ ��
��4��������е�������MnO2�����������õ缫�Ϸ����ķ�Ӧ����ʽΪ��ƷD�Ļ�ѧʽΪ �� �����ʶ����������������� ��
���𰸡�
��1��MnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O
��2��Cu��Cd
��3����Fe2+����ΪFe3+��Zn��OH��2
��4������Mn2+��2e��+2H2O=MnO2+4H+��H2SO4���ܽ����̿���п����ѭ������
���������⣺��1��MnO2��������Һ�зֱ��CuS��FeS����������ԭ��Ӧ��MnԪ�صĻ��ϼ۽��ͣ�SԪ�صĻ��ϼ����ߣ���FeԪ�ػ��ϼ����ߣ��ɵ��ӡ�ԭ���غ��֪����Ӧ�ֱ�ΪMnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O�����Դ��ǣ�MnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O����2������ڼ������п�������·�Ӧ��Zn+CuSO4�TZnSO4+Cu��Zn+CdSO4�TZnSO4+Cd��Zn+2Fe3+�TZn2++2Fe2+ �� ���˵���ҺB�����еijɷ���MnSO4��Al2��SO4��3��ZnSO4��FeSO4 �� ����������Cu��Cd�����Ի��գ����Դ��ǣ�Cu��Cd����3����ת����֪�������ӡ�������ת��Ϊ����������һ��ΪMnO2 �� �������ǽ�Fe2+����ΪFe3+������һ�ֹ������ʿ�ΪZn��OH��2��Mn��OH��2��ZnCO3��MnCO3�ȣ��ٽ�������ˮ��ת��Ϊ���������Դ��ǣ���Fe2+����ΪFe3+��Zn��OH��2����4����MnԪ��ʧȥ���ӣ���֪������е�������MnO2�������������õ缫�Ϸ����ķ�Ӧ����ʽΪMn2+��2e��+2H2O=MnO2+4H+ �� ��������Ӳ��䣬�����������ӣ���֪��ƷD�Ļ�ѧʽΪH2SO4 �� �����ʶ����������������������ܽ����̿����п��ѭ��ʹ�ã����Դ��ǣ�����Mn2+��2e��+2H2O=MnO2+4H+��H2SO4�������ܽ����̿����п��ѭ��ʹ�ã�

����Ŀ����ҵ�Ͽ�����ú���������CO��H2���ϳɶ����ѣ�CH3OCH3��ͬʱ���ɶ�����̼����������Ӧ���£�
��2H2��g��+CO��g��CH3OH ��g����H=��90.8kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.3kJmol��1
��1���ܺϳɷ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��һ�������µ��ܱ������У������ܷ�Ӧ�ﵽƽ��ʱ��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ĸ���ţ���
A.���¸�ѹ
B.�������
C.����CO2��Ũ��
D.����CO��Ũ��
E.�����������
��3����֪��Ӧ��2CH3OH��g��CH3OCH3��g��+H2O��g����ij�¶��µ�ƽ�ⳣ��K=400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�������
���� | CH3OH | CH3OCH3 | H2O |
c/molL��1 | 0.44 | 0.60 | 0.60 |
��ʱ��v������v���棩 ���������������=�������ﵽƽ���CH3OCH3�����ʵ���Ũ���� ��