题目内容
【题目】下列实验方案能达到实验目的的是
A. 证明浓度的的改变可导致平衡移动:将少量KCl晶体加入FeCl3+3KSCN![]() Fe(SCN)3+3KCl的平衡体系中
Fe(SCN)3+3KCl的平衡体系中
B. 除去MgCl2溶液中少量的FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤
C. 检验某溶液中是否含有乙醛:向盛有2mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热
D. 证明Fe3+的氧化性大于I2:将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色
【答案】BD
【解析】
A. FeCl3+3KSCN![]() Fe(SCN)3+3KCl的平衡体系的实质是Fe3++3SCN-
Fe(SCN)3+3KCl的平衡体系的实质是Fe3++3SCN-![]() Fe(SCN)3,加入少量KCl晶体,对该平衡无影响,错误;B.Fe3+水解生成氢氧化铁和氢离子,加入足量的Mg(OH)2粉末,氢离子和氢氧化镁反应,促进铁离子水解,故 除去MgCl2溶液中少量的FeCl3,可向混合液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤,正确;C. 用新制氢氧化铜悬浊液检验某溶液中是否含有乙醛时,制备氢氧化铜时必须保证碱过量,错误;D. 证明Fe3+的氧化性大于I2: KI溶液和FeCl3溶液混合发生反应:2Fe3++2I-==2Fe2++I2,Fe3+为氧化剂,I2为氧化产物,Fe3+的氧化性大于I2,正确。
Fe(SCN)3,加入少量KCl晶体,对该平衡无影响,错误;B.Fe3+水解生成氢氧化铁和氢离子,加入足量的Mg(OH)2粉末,氢离子和氢氧化镁反应,促进铁离子水解,故 除去MgCl2溶液中少量的FeCl3,可向混合液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤,正确;C. 用新制氢氧化铜悬浊液检验某溶液中是否含有乙醛时,制备氢氧化铜时必须保证碱过量,错误;D. 证明Fe3+的氧化性大于I2: KI溶液和FeCl3溶液混合发生反应:2Fe3++2I-==2Fe2++I2,Fe3+为氧化剂,I2为氧化产物,Fe3+的氧化性大于I2,正确。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】以下元素均为短周期元素:
元素代号 | 相关信息 |
M | 非金属元素,其气态氢化物的水溶液呈碱性 |
A | A的单质与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是内层电子数的三倍 |
C | 在第三周期中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)B在周期表中的位置______,C离子的结构示意图_______。
(2)D的最低价含氧酸的电子式______。
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式____。(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:______。
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为 ___________。
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
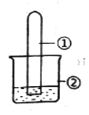
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D