题目内容
【题目】以下元素均为短周期元素:
元素代号 | 相关信息 |
M | 非金属元素,其气态氢化物的水溶液呈碱性 |
A | A的单质与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是内层电子数的三倍 |
C | 在第三周期中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)B在周期表中的位置______,C离子的结构示意图_______。
(2)D的最低价含氧酸的电子式______。
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式____。(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:______。
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为 ___________。
【答案】第二周期第VIA族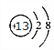
![]() 2NH3 - 6e- + 6OH- === N2+6H2O4Na+CCl4
2NH3 - 6e- + 6OH- === N2+6H2O4Na+CCl4![]() 4NaCl+CCO32-+Cl2+H2O = ClO—+Cl-+HCO-3
4NaCl+CCO32-+Cl2+H2O = ClO—+Cl-+HCO-3
【解析】
M的氢化物的水溶液呈碱性,推出M为N,A的单质与冷水剧烈反应,得到强碱性溶液,推出A为Na,B的原子最外层电子数是内层电子数的三倍,推出B为O,C的简单离子半径在第三周期中最小,推出C为Al,A、B、D组成的36电子化合物,是家用消毒剂的主要成分,此化合物X为NaClO,因此D为Cl,E是所有有机物中都含的元素,即E为C,(1)根据上述分析,B位于第二周期VIA族,C的离子是Al3+,结构示意图是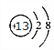 ;(2)Cl的最低价含氧酸是HClO,其电子式为
;(2)Cl的最低价含氧酸是HClO,其电子式为![]() ;(3)M的简单氢化物是NH3,与氧气构成电池,负极是化合价升高,NH3在负极上失去电子,环境是碱性,因此负极电极反应式为:2NH3+6OH--6e-=N2+6H2O;(4)Y是CCl4,硬度最大的物质是C,金属钠把C置换出来,因此发生反应是4Na+CCl4
;(3)M的简单氢化物是NH3,与氧气构成电池,负极是化合价升高,NH3在负极上失去电子,环境是碱性,因此负极电极反应式为:2NH3+6OH--6e-=N2+6H2O;(4)Y是CCl4,硬度最大的物质是C,金属钠把C置换出来,因此发生反应是4Na+CCl4![]() 4NaCl+C;(5)组成生活中常见的盐可能是NaHCO3,也可能是Na2CO3,根据Na的质量分数是43%,推出此盐为Na2CO3,Cl2+H2O=HCl+HClO,因为是1:1,反应有Na2CO3+HCl=NaHCO3+NaCl,Na2CO3+HClO=NaHCO3+NaClO,综合得出反应:CO32-+Cl2+H2O=ClO-+Cl-+HCO3-。
4NaCl+C;(5)组成生活中常见的盐可能是NaHCO3,也可能是Na2CO3,根据Na的质量分数是43%,推出此盐为Na2CO3,Cl2+H2O=HCl+HClO,因为是1:1,反应有Na2CO3+HCl=NaHCO3+NaCl,Na2CO3+HClO=NaHCO3+NaClO,综合得出反应:CO32-+Cl2+H2O=ClO-+Cl-+HCO3-。

