题目内容
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
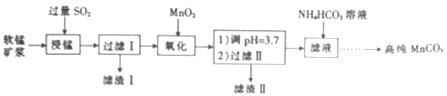
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
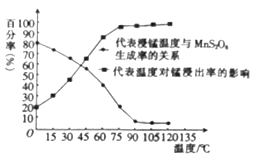
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________。
【答案】Mn2+Fe2+MnO2+SO2=MnSO490℃防止NH4HCO3受热分解,提高原料利用率Mn2++2HCO3-=MnCO3↓+CO2↑+H2O取1-2mL最后一次的洗涤于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明乙洗涤干净
【解析】试题分析:分析信息和工艺流程知向软锰矿浆通入过量二氧化硫,浸锰,酸性条件下,利用二氧化硫的还原性将二氧化锰、氧化铁分别还原为硫酸锰和硫酸亚铁,过滤,滤渣Ⅰ为二氧化硅,向滤液中加入过量二氧化锰,过量的二氧化硫和二氧化锰反应生成硫酸锰,将Fe2+氧化为Fe3+,调pH=3.7,将Fe3+转化为氢氧化铁沉淀,过滤,滤渣Ⅱ为氢氧化铁和二氧化锰,滤液为硫酸锰溶液,向滤液种加入适量NH4HCO3溶液,发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,过滤、洗涤、干燥,得碳酸锰(MnCO3)。据此作答。
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为Mn2+和Fe2+。
(2)氧化过程中,MnO2与SO2反应生成硫酸锰,化学方程式为MnO2+SO2=MnSO4。
(3)分析图像知温度在90℃以后MnS2O6的生成率较低,锰的浸出率较高,且温度较低节约能源,故“浸锰”的适宜温度是90℃。
(4)铵盐受热易分解,向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃的原因是防止NH4HCO3受热分解,提高原料利用率。
(5)硫酸锰与NH4HCO3溶液反应生成MnCO3沉淀、水和二氧化碳,反应的离子方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。
(6)生成的MnCO3沉淀表面有硫酸根等杂质离子,检验沉淀是否洗涤干净可检验最后一次洗涤液中是否含有硫酸根,检验洗涤是否完全的方法是取1-2mL最后一次的洗涤于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明乙洗涤干净。


