题目内容
14.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X、Y的简单离子具有相同电子层结构.Y与W形成的离子化合物是日常生活中常用的调味品,X与Z同族,且Z的原子序数是X的两倍.下列推测正确的是( )| A. | X和Y形成的化合物中一定不含共价键 | |
| B. | W的氧化物的水化物是强酸 | |
| C. | ZX2能使酸性KMnO4溶液褪色,说明ZX2具有漂白性 | |
| D. | X和Z的简单氢化物沸点差异大,主要原因是氢键的影响 |
分析 X、Y、Z、W是原子序数依次增大的四种短周期主族元素,Y与W形成的离子化合物是日常生活中常用的调味品,化合物为NaCl,则Y为Na,W为Cl,X、Y的简单离子具有相同电子层结构.X与Z同族,且Z的原子序数是X的两倍,则X为O,Z为S,以此来解答.
解答 解:由上述分析可知,X为O,Y为Na,Z为S,Z为Cl,
A.X和Y形成的化合物若为Na2O2,含离子键、共价键,故A错误;
B.W的氧化物若为亚硫酸,水化物是弱酸,若为三氧化硫,水化物为强酸,故B错误;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应,SO2具有还原性,故C错误;
D.X的氢化物为水,分子间含氢键,则沸点大于Z的简单氢化物,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数来推断元素为解答的关键,侧重分析与应用能力的考查,注意氯化钠为突破口,题目难度不大.

练习册系列答案
相关题目
4.用下列实验装置进行相应的实验,设计正确且能达到实验目的是( )
| A. |  用图所示装置验证反应产物二氧化碳 | |
| B. |  装置可用于证明SO2与NaOH溶液发生了反应 | |
| C. |  若装置中X为CCl4,可用于吸收氨气或氯化氢 | |
| D. |  装置 可用于实验室从食盐水中提取氯化钠 |
2.下列氢化物中不属于分子晶体的是( )
| A. | NaH | B. | H2O | C. | CH4 | D. | HCl |
9.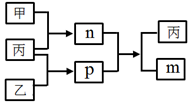 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:A<B<C | |
| B. | BD2分子中所有原子都达到了8电子稳定结构 | |
| C. | C与D的简单氢化物沸点,后者高 | |
| D. | 非金属性:D>C>B |
6.下列离子方程式正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-═CaCO3↓ | |
| D. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O |
14.用丁达尔效应能区分的一组物质是( )
| A. | NaCl溶液和NaOH溶液 | B. | 稀硫酸和稀醋酸 | ||
| C. | Fe(OH)3胶体和溴水 | D. | Ba(OH)2溶液和澄清石灰水 |
15. 化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )
化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )
 化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )
化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )| A. | 若采用电镀的方法,镀件应与电源正极连接 | |
| B. | 若用铜盐进行化学镀铜,镀件做氧化剂 | |
| C. | 可以调节溶液的 pH 至 8-9 之间使反应停止 | |
| D. | 同等条件下,使用化学镀比电镀反应速率更快 |



 据图回答下列问题:
据图回答下列问题: