题目内容
5.某原电池的总反应为:Zn+Cu2+=Zn2++Cu,该原电池的正确组成是( )| A. |  | B. | 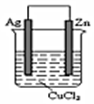 | ||
| C. |  | D. |  |
分析 原电池的总反应为:Zn+Cu2+=Zn2++Cu,Zn为负极,比Zn不活泼的金属或惰性电极作正极,电解质溶液含铜离子,以此来解答.
解答 解:A.电解质为硫酸,正极上生成氢气,故A不选;
B.Zu为负极,Ag为正极,铜离子在正极得到电子,原电池的总反应为:Zn+Cu2+=Zn2++Cu,故B选;
C.不能发生反应,不能构成原电池,故C不选;
D.没有形成闭合回路,不能构成原电池,故D不选;
故选B.
点评 本题考查原电池,为高频考点,把握原电池的构成条件、电极反应为解答的关键,侧重分析与应用能力的考查,注意原电池的工作原理,题目难度不大.

练习册系列答案
相关题目
15.已知:2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,CO(g)+$\frac{1}{2}$ O2(g)?CO2(g)△H=-282.8kJ•mol-1,现有CO、H2和CO2组成的混合气体112.0L(标准状况),经完全燃烧后放出的总热量为851.4kJ,并生成18g液态水.则燃烧前混合气体中CO的体积分数为( )
| A. | 80% | B. | 40% | C. | 60% | D. | 20% |
16.下列溶液中的c(Cl-)与100mL1mol/L的AlCl3溶液c(Cl-)相等的是( )
| A. | 200mL1mol/L的NaCl溶液 | B. | 150mL3mol/L的KCl溶液 | ||
| C. | 150mL2mol/LNH4Cl溶液 | D. | 100mL1.5mol/L的MgCl2溶液 |
20.某气态烃0.5mol能与1mol HCl完全加成,加成后产物分子上的氢原子又可被2mol Cl2完全取代,则此气态烃可能是( )
| A. | HC≡CH | B. | CH2═CH2 | C. | CH3-C≡CH | D. | CH2═C(CH3)2 |
17.下列叙述正确的是( )
| A. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$减小 | |
| C. | 室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液相比,一定有c(Na+)-c(F-)<c(K+)-c(CH3COO-)成立 | |
| D. | 在25℃时,将0.01 mol/L的氨水与0.01 mol/L的盐酸混合,充分反应后溶液中若c(NH4+)=c(Cl-),则氨水所用的体积一定大于盐酸的体积 |
14.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X、Y的简单离子具有相同电子层结构.Y与W形成的离子化合物是日常生活中常用的调味品,X与Z同族,且Z的原子序数是X的两倍.下列推测正确的是( )
| A. | X和Y形成的化合物中一定不含共价键 | |
| B. | W的氧化物的水化物是强酸 | |
| C. | ZX2能使酸性KMnO4溶液褪色,说明ZX2具有漂白性 | |
| D. | X和Z的简单氢化物沸点差异大,主要原因是氢键的影响 |
6.一定温度下,2L密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)?2NO2(g),一段时间后达到平衡,测得数据如表:
请回答:
(1)20s内,v(NO2)=0.006mol•L-1•s-1;
(2)升高温度时,气体颜色加深,则正反应是吸热(填“放热”或“吸热”)反应;
(3)该温度下反应的化学平衡常数K为1.8;
(4)升高温度后再次达到平衡后的平衡常数为K2,则K2>K(填“大于”“小于”或“等于”).
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
(1)20s内,v(NO2)=0.006mol•L-1•s-1;
(2)升高温度时,气体颜色加深,则正反应是吸热(填“放热”或“吸热”)反应;
(3)该温度下反应的化学平衡常数K为1.8;
(4)升高温度后再次达到平衡后的平衡常数为K2,则K2>K(填“大于”“小于”或“等于”).
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有55个电子,在周期表中的位置如图所示.C的单质可与酸反应,1molC单质与足量酸作用,在标准状况下能产生33.6L的H2;A的最外层电子数是次外层电子数的2倍.答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有55个电子,在周期表中的位置如图所示.C的单质可与酸反应,1molC单质与足量酸作用,在标准状况下能产生33.6L的H2;A的最外层电子数是次外层电子数的2倍.答下列问题: