题目内容
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.甲烷气体在O2中的燃烧反应 |
C
解析试题分析:A选项,为放热反应。错误。B选项,不是氧化还原反应。C选项,正确。D选项,为放热反应。
考点:氧化还原反应,反应热。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+82kJ/mol |
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 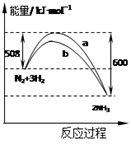
A.该反应的热化学方程式为:2NH3  N2+3H2ΔH =-92 kJ·mol-1 N2+3H2ΔH =-92 kJ·mol-1 |
| B.正反应的活化能小于逆反应的活化能 |
| C.a曲线是加入催化剂时的能量变化曲线 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8 kJ热量,表示该反应的热化学方程式正确的是
| A.2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol |
D.H2(g)+ O2(g)=H2O(l)△H=-285.8 kJ/mol O2(g)=H2O(l)△H=-285.8 kJ/mol |
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
已知H2(g)+ Br2(l)→ 2HBr(g)+ 42 kJ。1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 1 mol 分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
A、404 B、344 C、230 D、200
下列说法或表示方法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 |
| B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定 |
| C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol |
| D.2A (l) + B (l) =" 2C" (l) △H1 2A (g) + B (g) =" 2C" (l)△H2 则ΔH1>ΔH2 |

