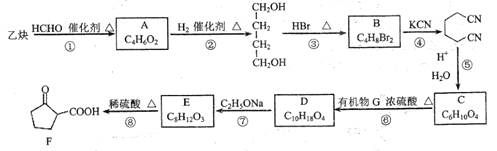
题目内容
【题目】下列说法正确的是( )
A.醋酸钠溶液呈碱性,往0.1mol·L-1醋酸溶液加入少量醋酸钠固体后,可促进醋酸电离
B.T℃时,pH为6.8的溶液,该溶液一定呈酸性
C.相同温度下,pH相等的氨水、NaOH溶液中,n(NH4+)与n(Na+)相等
D.pH相等的盐酸和醋酸溶液等体积混合(忽略温度和体积变化),混合溶液中c(Cl-) = c(CH3COO-)
【答案】D
【解析】
A.醋酸的电离平衡为:CH3COOH![]() CH3COO-+H+,加入醋酸钠固体,CH3COO-浓度增大,醋酸电离平衡逆向移动,抑制醋酸电离,A错误;
CH3COO-+H+,加入醋酸钠固体,CH3COO-浓度增大,醋酸电离平衡逆向移动,抑制醋酸电离,A错误;
B.判断溶液的酸碱性,要通过比较H+和OH-浓度的相对大小来判断,不能单从pH角度来判断溶液的酸碱性,B错误;
C.没有给溶液的体积,无法判断n(NH4+)与n(Na+)是否相等,C错误;
D.两种溶液的pH相等,则混合前两种溶液中c(H+)和c(OH-)分别相等,因为是等体积混合,所以混合后溶液中c(H+)和c(OH-)和混合前相等。HCl溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(H+),混合后存在电荷守恒:c混(Cl-)+c混(OH-)+c混(CH3COO-)=c混(H+),所以c(Cl-)= c混(Cl-)+c混(CH3COO-),又因为是等体积混合,有c混(Cl-)=![]() c(Cl-),所以,c混(CH3COO-)= c(Cl-)-
c(Cl-),所以,c混(CH3COO-)= c(Cl-)-![]() c(Cl-)=
c(Cl-)=![]() c(Cl-),综上所述:c混(Cl-)= c混(CH3COO-),即pH相等的盐酸和醋酸溶液等体积混合(忽略温度和体积变化),混合溶液中c(Cl-) = c(CH3COO-),D正确。
c(Cl-),综上所述:c混(Cl-)= c混(CH3COO-),即pH相等的盐酸和醋酸溶液等体积混合(忽略温度和体积变化),混合溶液中c(Cl-) = c(CH3COO-),D正确。
答案选D。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
元素 | 元素性质或原子结构信息 |
X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
Y | +3价阳离子的核外电子排布与氖原子相同 |
Z | 原子核外M电子层与K电子层的电子数相等 |
R | 与Z同周期,主要化合价为1、+7 |
W | 原子结构示意图: |
(1)写出元素X的原子结构示意图_____;元素W在周期表中位置_____。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____>_____(填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____。
(4)下列对于W及其化合物的推断中,正确的是_____(填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:
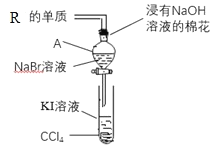
①A中发生的反应的离子方程式是_____。
②棉花中浸有的NaOH溶液的作用是_____(用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______。