题目内容
【题目】某医药中间体F的制备流程如图(部分产物已略去)。
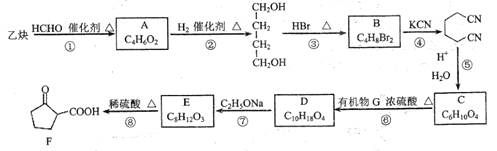
已知: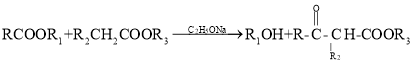 (
(![]() 表示烃基)
表示烃基)
(1)F中含有官能团的名称是羧基和_______。
(2)实验室制取乙炔的化学方程式为____________。
(3)A不能发生银镜反应,则A的结构简式为_________。
(4)反应①~④中,属于加成反应的是___________(填序号)。
(5)反应⑥的化学方程式为________。
(6)E的结构简式为________。
(7)某聚合物![]() 的单体与
的单体与![]() 互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为
互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为![]() ,且能与
,且能与![]() 溶液反应,则聚合物
溶液反应,则聚合物![]() 的结构简式是_______。
的结构简式是_______。
(8)已知:i. ![]() +
+![]()
![]()

ii.RCH=CHR′![]() RCHO+R′CHO(R,R′表示烃基)
RCHO+R′CHO(R,R′表示烃基)
以![]() 和
和![]() 为起始原料合成
为起始原料合成![]() ,选用必要的无机试剂,写出合成路线流程图: _______________。合成路流程图例:
,选用必要的无机试剂,写出合成路线流程图: _______________。合成路流程图例:![]()
【答案】羰基或酮基 ![]()
![]() ①、②
①、② 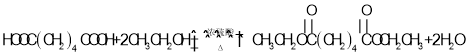
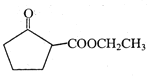
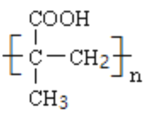
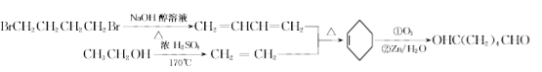
【解析】
A和氢气发生加成反应得到1,4-丁二醇,A不能发生银镜反应,结合A分子式知,A为HOCH2C≡CCH2OH,该反应为加成反应;1分子乙炔与2分子甲醛发生加成反应得到A,生成B的反应为取代反应,B为BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生取代反应生成NCCH2CH2CH2CH2CN,水解生成C为HOOCCH2CH2CH2CH2COOH,C和有机物G反应生成D,根据D的分子式知,该反应为酯化反应,则G为CH3CH2OH,D为CH3CH2OOCCH2CH2CH2CH2COOCH2CH3,D发生题给信息反应生成E为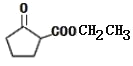 ,E发生水解反应得到F。
,E发生水解反应得到F。
(1)F为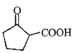 ,含有官能团的名称是羧基、羰基(或酮基),故答案为:羰基(或酮基)。
,含有官能团的名称是羧基、羰基(或酮基),故答案为:羰基(或酮基)。
(2)实验室用电石和水制取乙炔,其化学反应方程式为:![]() ↑,故答案为:
↑,故答案为:![]() ↑。
↑。
(3)A和氢气发生加成反应得到1,4-丁二醇,且A不能发生银镜反应,说明A中无醛基,结合A的分子式可知,A为HOCH2C≡CCH2OH,故答案为:HOCH2C≡CCH2OH。
(4)1分子乙炔与2分子甲醛发生加成反应得到HOCH2C≡CCH2OH,HOCH2C≡CCH2OH和氢气发生加成反应得到1,4-丁二醇,生成B的反应为取代反应,B为BrCH2CH2CH2CH2Br,B发生取代反应生成NCCH2CH2CH2CH2CN,所以反应①~④中,属于加成反应的是①、②,故答案为:①、②。
(5)C为HOOCCH2CH2CH2CH2COOH,C和有机物G反应生成D,根据D的分子式知,该反应为酯化反应,则G为CH3CH2OH,D为CH3CH2OOCCH2CH2CH2CH2COOCH2CH3,其化学反应方程式为: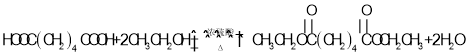 ,故答案为:
,故答案为: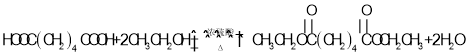 。
。
(6)D发生题给信息反应生成E,E的结构简式为: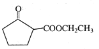 ,故答案为:
,故答案为:![]() 。
。
(7)A为HOCH2C≡CCH2OH,其分子式为:C4H6O2,某聚合物![]() 的单体与
的单体与![]() 互为同分异构体,该单体核磁共振氢谱有三个峰,说明有三种不同环境的氢原子,且峰面积之比为
互为同分异构体,该单体核磁共振氢谱有三个峰,说明有三种不同环境的氢原子,且峰面积之比为![]() ,能与
,能与![]() 溶液反应,说明含羧基,H的结构简式为
溶液反应,说明含羧基,H的结构简式为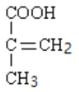 ,聚合物
,聚合物![]() 的结构简式:
的结构简式: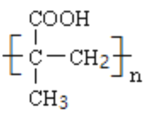 ,故答案为:
,故答案为: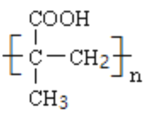 。
。
(8)B为BrCH2CH2CH2CH2Br,G为CH3CH2OH,以B、G为起始原料合成![]() ,结合题给已知反应,其合成路线为:
,结合题给已知反应,其合成路线为: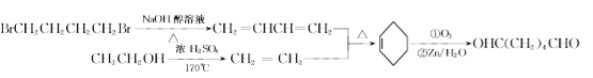 ,故答案为:
,故答案为:
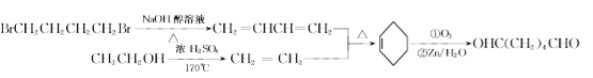 。
。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅, 30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:5H2C2O4 + 2MnO4- + 6H+ === 2Mn2+ + ______ +______
(2)由实验I、II可得出的结论是______。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,______,最后加入1 mL 0.1 mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。
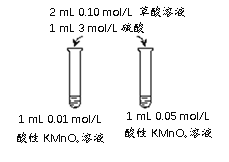
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。
【题目】下列实验方案设计中,能达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究浓度对化学反应速率的影响 | 两支试管中分别盛有 |
B | 探究蔗糖水解产物的还原性 | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜悬浊液并加热,观察是否产生红色沉淀 |
C | 探究浓度对化学平衡的影响 | 向 |
D | 检验溶液中的 | 向溶液中加入盐酸酸化的氯化钡溶液,观察是否产生白色沉淀 |
A.AB.BC.CD.D
【题目】实验小组制备高铁酸钾![]() 并探究其性质。
并探究其性质。
资料:![]() 为紫色固体,微溶于
为紫色固体,微溶于![]() 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备![]() (夹持装置略)
(夹持装置略)
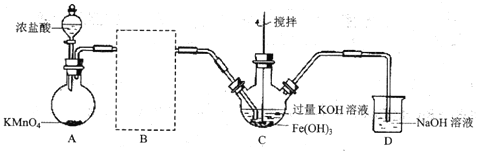
①A为氯气发生装置。A中反应的离子方程式为_________(锰被还原为![]() )。
)。
②请在B方框内将除杂装置补充完整,并标明所用试剂__________。
③![]() 中得到紫色固体和溶液。
中得到紫色固体和溶液。![]() 中主要反应的化学方程式为___________。
中主要反应的化学方程式为___________。
(2)探究![]() 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有![]() 。为证明是否
。为证明是否![]() 氧化了
氧化了![]() 而产生
而产生![]() ,设计以下方案:
,设计以下方案:
方案Ⅰ | 取少量a,滴加 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 |
由方案Ⅰ中溶液变红可知a中含有的离子为____,但该离子的产生不能判断一定是![]() 将
将![]() 氧化,该离子还可能由_______产生(用离子方程式表示)。
氧化,该离子还可能由_______产生(用离子方程式表示)。
②根据![]() 的制备实验得出:氧化性
的制备实验得出:氧化性___________
![]() (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明,![]() 和
和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() ,验证实验如下:将溶液
,验证实验如下:将溶液![]() 滴入
滴入![]() 和足量
和足量![]() 的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______________。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______________。
【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
向一支试管中先加入 1mL 0.01 mol/L 酸性KMnO4 溶液,再加入 1 滴 3mol/L 硫酸和 9 滴蒸馏水,最后加入1mL 0.1mol/L 草酸溶液 | 前 10min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 | |
Ⅱ | 向另一支试管中先加入 1mL 0.01mol/L 酸性KMnO4 溶液,再加入 10 滴 3mol/L 硫酸,最后加入 1mL 0.1mol/L 草酸溶液 | 80s 内溶液紫色无明显变化,后颜色迅速变浅,约150s 后几乎变为无色 |
(1)将高锰酸钾与草酸反应的离子方程式补充完整__________:
□MnO![]() +□H2C2O4 + □ = □Mn2+ +□ +□H2O
+□H2C2O4 + □ = □Mn2+ +□ +□H2O
(2)由实验 I、Ⅱ可得出的结论是_____。
(3)关于实验Ⅱ中 80s 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 Mn2+ 对反应有催化作用。设计实验 Ⅲ,验证猜想。
① 补全实验Ⅲ的操作:
向试管中先加入 1mL 0.01mol/L 酸性 KMnO4 溶液,_____,最后加入 1mL 0.1mol/L 草酸溶液。
②若猜想成立,应观察到的实验现象是________。