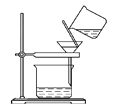
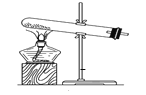
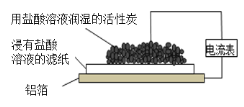
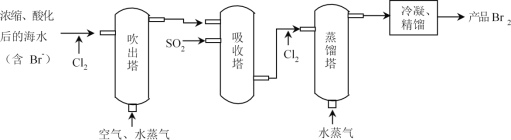
题目内容
【题目】反应2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) ΔH<0可用于消除汽车尾气中的有害气体。在密闭容器中充入4 mol NO 和5 mol CO,平衡时NO的体积分数随温度、压强的变化关系如图。下列说法不正确的是
N2(g) + 2CO2(g) ΔH<0可用于消除汽车尾气中的有害气体。在密闭容器中充入4 mol NO 和5 mol CO,平衡时NO的体积分数随温度、压强的变化关系如图。下列说法不正确的是
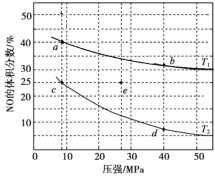
A.温度:T1>T2
B.a点达到平衡所需时间比c点短
C.c点NO的平衡转化率:50%
D.若在e点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中的c点
【答案】D
【解析】
A.由图可知,相同压强下,T1温度时NO的体积分数更大,说明T1温度下,反应向右进行的程度更小;由于该反应为放热反应,所以温度越低,越有利于反应正向进行,所以T1>T2;A项正确;
B.一般,温度越高,反应速率越大,达到平衡所需的时间会越短,所以a点达到平衡所需的时间比c点短;B项正确;
C.c点对应的平衡状态,NO的体积分数为25%,所以列三段式:
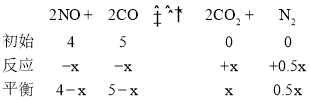 ,所以有:
,所以有:![]() ,解得x=2,那么NO的平衡转化率即:50%,C项正确;
,解得x=2,那么NO的平衡转化率即:50%,C项正确;
D.由图可知,e点对应的NO的体积分数与c点对应的相同;结合反应可知,升温会使反应逆向移动,导致NO的体积分数会增加,减压也会使反应逆向移动,导致NO的体积分数增加;所以升温和减压后,NO的体积分数必然增加,达到平衡状态时,NO的体积分数一定比c点对应的体积分数大,D项错误;
答案选D。

【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
向一支试管中先加入 1mL 0.01 mol/L 酸性KMnO4 溶液,再加入 1 滴 3mol/L 硫酸和 9 滴蒸馏水,最后加入1mL 0.1mol/L 草酸溶液 | 前 10min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 | |
Ⅱ | 向另一支试管中先加入 1mL 0.01mol/L 酸性KMnO4 溶液,再加入 10 滴 3mol/L 硫酸,最后加入 1mL 0.1mol/L 草酸溶液 | 80s 内溶液紫色无明显变化,后颜色迅速变浅,约150s 后几乎变为无色 |
(1)将高锰酸钾与草酸反应的离子方程式补充完整__________:
□MnO![]() +□H2C2O4 + □ = □Mn2+ +□ +□H2O
+□H2C2O4 + □ = □Mn2+ +□ +□H2O
(2)由实验 I、Ⅱ可得出的结论是_____。
(3)关于实验Ⅱ中 80s 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 Mn2+ 对反应有催化作用。设计实验 Ⅲ,验证猜想。
① 补全实验Ⅲ的操作:
向试管中先加入 1mL 0.01mol/L 酸性 KMnO4 溶液,_____,最后加入 1mL 0.1mol/L 草酸溶液。
②若猜想成立,应观察到的实验现象是________。