题目内容
【题目】某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:
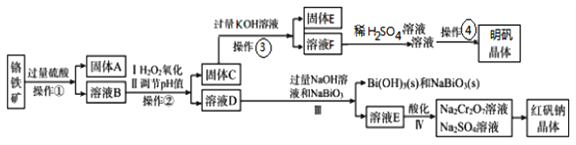
己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II目的是___________。
(2)实验室中操作④的名称为_______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3]=3×10-33。当pH=5.6时Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________(杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________(结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式_________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
【答案】 使Fe2+转化为Fe3+,并调整pH,使Fe3+和Al3+完全沉淀,与铬元素完全分离 蒸发浓缩,冷却结晶,过滤 5.0≤pH<5.6 3NaBiO3+2Cr3++7OH-+H2O = 2CrO42-+3Na++3Bi(OH)3 酸性条件下CrO42-或Cr2O72-会被Cl-还原为Cr3+ Cr2O72-+6Cl-+l4H+=2Cr3++3Cl2+7H2O AlO2-+4H+ = Al3++2H2O c (K+) >c (HCO3-) >c (OH-) >c (H+) >c (CO32-)
【解析】本题考查工艺流程分析,铬铁矿的主要成份为Al2O3·Cr2O3,还含有FeO、SiO2,向铬铁矿中加入过量的硫酸,氧化铝、氧化亚铁和Cr2O3与硫酸反应生成硫酸铝、硫酸亚铁和硫酸铬,SiO2与硫酸不反应,过滤,得到固体A为SiO2,溶液B为硫酸铝、硫酸亚铁和硫酸铬的混合溶液,加入H2O2将Fe2+氧化成Fe3+,调节pH形成氢氧化铝和氢氧化铁沉淀,过滤,得到固体C为氢氧化铁和氢氧化铝的混合物,溶液D为硫酸铬溶液,向固体C中加入过量的KOH溶液,得到氢氧化铁沉淀和偏铝酸钾溶液,固体E为氢氧化铁,溶液F为偏铝酸钾溶液,加入稀硫酸,然后蒸发浓缩,冷却结晶,过滤得到明矾;向溶液D中加入过量的NaOH溶液和NaBiO3溶液,发生氧化还原反应生成Bi(OH)3固体和Na2CrO4溶液,溶液E为Na2CrO4溶液,然后酸化得到Na2Cr2O7溶液和Na2SO4溶液,最终得到红矾钠晶体。
(1)根据上述分析,I、II 操作的目的是使Fe2+转化为Fe3+,并调整pH,使Fe3+和Al3+完全沉淀,与铬元素完全分离 。
(2)操作④是由溶液得到晶体的过程,名称为蒸发浓缩,冷却结晶,过滤。
(3)使Al3+完全除去时c(OH-)3=Ksp[Al(OH)3]÷c(Al3+)=1×10-33÷1×10-6mol/L= 1×10-27,c(OH-)=10-9mol/L,此时溶液pH=5.0,使Fe3+完全除去时c(OH-)3=Ksp[Fe(OH)3]÷c(Fe3+)=3.0×10-39÷1×10-6mol/L= 3×10-33,c(OH-)≈1.4× 10-11mol/L,此时溶液pH≈3.1,而pH=5.6时Cr(OH)3开始沉淀,所以调节溶液的pH范围为5.0≤pH<5.6。
(4)NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-,根据得失电子守恒、电荷守恒和原子守恒配平,Ⅲ中发生反应的离子方程式3NaBiO3+2Cr3++7OH-+H2O = 2CrO42-+3Na++3Bi(OH)3。
(5)因为反应Cr2O72-+6Cl-+l4H+=2Cr3++3Cl2+7H2O,酸性条件下CrO42-或Cr2O72-会被Cl-还原为Cr3+ ,所以IV中酸化是用硫酸而不用盐酸酸化。
(6)溶液F为偏铝酸钾溶液,偏铝酸钾和硫酸反应生成硫酸铝,反应的离子方程式为AlO2-+4H+ = Al3++2H2O。将足量二氧化碳通入偏铝酸钾溶液中生成氢氧化铝沉淀和碳酸氢钾溶液,碳酸氢钾是强碱弱酸盐,HCO3-在溶液中存在水解过程和电离过程,以水解过程为主,溶液显碱性,水解过程是微弱的,则生成的溶液中离子浓度关系为c (K+) >c (HCO3-) >c (OH-) >c (H+) >c (CO32-)。

 阅读快车系列答案
阅读快车系列答案