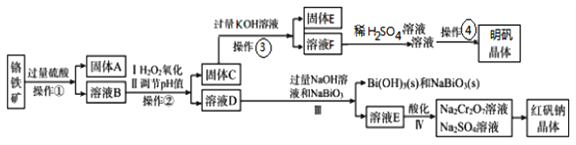
题目内容
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:CO (g) +2H2(g)![]() CH3OH(l) △H=?
CH3OH(l) △H=?
(1)己知CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol 则△H=______。
(2)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO (g) +2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
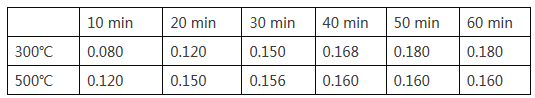
①由上述数据可以判断:T1℃_____T2℃
②T1℃时,0~20minH2的平均反应速率v(H2)=_________。
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲醇 E.增加CO的浓度
(3)若保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件___________。
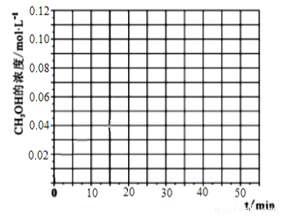
(4)当反应在T1℃达到20min时,控制体积不变,迅速将0.02molCO,0.04molH2,0.18molCH3OH同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出2040min内容器中 H2浓度的变化趋势曲线:___________
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__________;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
【答案】 -128.1kJ/mol < 0.006mol/(L·min) C、E a+c=0.2,b+c/2=0.4  CH3OH-6e-+H2O=CO2+6H+ 80%
CH3OH-6e-+H2O=CO2+6H+ 80%
【解析】本题考查盖斯定律的应用、化学反应速率的计算和影响因素,等效平衡以及影响平衡的因素,化学图像和燃料电池等知识,利用基础知识解答。
(1)因为CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,所以①CO(g)+ ![]() O2(g)=CO2(g) △H=-283.0kJ/mol、②H2(g)+
O2(g)=CO2(g) △H=-283.0kJ/mol、②H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJ/mol、③CH3OH(l)+
O2(g)=H2O(l)△H=-285.8kJ/mol、③CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol,根据盖斯定律,①+2×②-③得CO (g) +2H2(g)
O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol,根据盖斯定律,①+2×②-③得CO (g) +2H2(g)![]() CH3OH(l)的△H=-283.0kJ/mol-285.8kJ/mol×2+726.5kJ/mol=-128.1kJ/mol。
CH3OH(l)的△H=-283.0kJ/mol-285.8kJ/mol×2+726.5kJ/mol=-128.1kJ/mol。
(2)①根据上述分析,CO和氢气反应生成甲醇的反应是放热反应,升高温度,平衡逆向移动,达平衡时甲醇的物质的量减少,再根据表格提供的数据可判断,T1℃<T2℃;②T1℃时,0~20min时生成甲醇0.120mol,则反应掉氢气0.240mol,所以H2的平均反应速率v(H2)=0.240mol÷(2L×20min)=0.006mol/(L·min);③A.改用高效催化剂只能加快反应速率,不能改变平衡,故A错误;B.升高温度,平衡逆向移动,甲醇的生成量减少,故B错误;C.缩小容器体积 ,增大压强,平衡正向移动,反应速率加快且甲醇的生成量增加,故C正确;D.分离出甲醇导致化学反应速率减慢,故D错误; E.增加CO的浓度,平衡正向移动,反应速率加快且甲醇的生成量增加,故E正确;故选CE。
(3)在一容积为2L的恒容密闭容器中,原平衡起始加入0.2mol CO和0.4mol H2,根据等效平衡理论,将生成物全部转移到左边,使得左边反应物CO为0.2mol,氢气为0.4mol,就能得到等效平衡,所以保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,a、b、c满足的条件为a+c=0.2,b+c/2=0.4。
(4)根据题给数据,20min时氢气的浓度为0.5mol/L,起始加入0.2mol CO和0.4mol H2,20min时再加入0.02molCO,0.04molH2,0.18molCH3OH,相当于加入0.2molCO和0.4mol氢气,在恒压条件下,反应在40min时达到平衡,与原平衡是等效平衡,平衡时氢气的浓度为0.02mol/L,所以2040min内容器中 H2浓度的变化趋势曲线为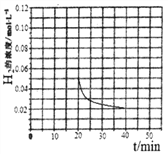 。
。
(5)酸性条件下甲醇燃料电池的总反应式为:CH3OH+![]() O2═CO2+2H2①,酸性条件下该燃料电池的正极反应式为
O2═CO2+2H2①,酸性条件下该燃料电池的正极反应式为![]() O2+6H++6e-═3H2②,①-②得电池负极反应式为:CH3OH-6e-+H2O=CO2+6H+ ;该燃料电池的理论效率为1162.4÷(726.5×2)×100%=80%。
O2+6H++6e-═3H2②,①-②得电池负极反应式为:CH3OH-6e-+H2O=CO2+6H+ ;该燃料电池的理论效率为1162.4÷(726.5×2)×100%=80%。

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案