题目内容
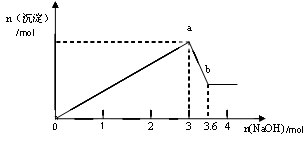
(6分)某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。
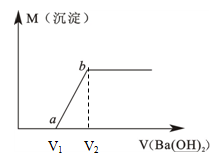
(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C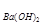 = 。
= 。

(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C
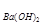 = 。
= 。(6分)
(1)HCl,CuCl2
(2)H++OH- H2O Cu2++2OH-
H2O Cu2++2OH- Cu(OH)2↓
Cu(OH)2↓
(3)取最后一次洗涤液少许,加入酸化AgNO3,若无沉淀,则已洗净(或检验Ba2+)
(4)1.5mol /L (2分)
(1)HCl,CuCl2
(2)H++OH-
 H2O Cu2++2OH-
H2O Cu2++2OH- Cu(OH)2↓
Cu(OH)2↓(3)取最后一次洗涤液少许,加入酸化AgNO3,若无沉淀,则已洗净(或检验Ba2+)
(4)1.5mol /L (2分)
向该混合溶液中滴加Ba(OH)2溶液,一开始并没有沉淀产生,所以原溶液不可能有碳酸钠和硫酸;原溶液肯定有:HCl,CuCl2。
(2)图中a点之前的离子方程式:H++OH- H2O;图中a→b点的离子方程式:Cu2++2OH-
H2O;图中a→b点的离子方程式:Cu2++2OH- Cu(OH)2↓,得到氢氧化铜蓝色絮状沉淀。
Cu(OH)2↓,得到氢氧化铜蓝色絮状沉淀。
(3)判断沉淀是否完全洗净,主要是查有无氯离子的存在,检验氯离子的办法:取最后一次洗涤液少许,加入酸化AgNO3,若无沉淀,则已洗净。
(4)b点时沉淀质量=2.94克,氢氧化铜物质的量为0.03mol,V1=20mL,V2=40mL,求C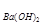 =
=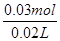 =1.5mol/L。
=1.5mol/L。
点评:对离子反应和离子方程式的考查,及简单相关计算。
(2)图中a点之前的离子方程式:H++OH-
 H2O;图中a→b点的离子方程式:Cu2++2OH-
H2O;图中a→b点的离子方程式:Cu2++2OH- Cu(OH)2↓,得到氢氧化铜蓝色絮状沉淀。
Cu(OH)2↓,得到氢氧化铜蓝色絮状沉淀。(3)判断沉淀是否完全洗净,主要是查有无氯离子的存在,检验氯离子的办法:取最后一次洗涤液少许,加入酸化AgNO3,若无沉淀,则已洗净。
(4)b点时沉淀质量=2.94克,氢氧化铜物质的量为0.03mol,V1=20mL,V2=40mL,求C
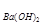 =
=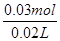 =1.5mol/L。
=1.5mol/L。点评:对离子反应和离子方程式的考查,及简单相关计算。

练习册系列答案
相关题目

 b变化过程的离子方程式 。
b变化过程的离子方程式 。 小颗粒,燃烧不一定需要氧气
小颗粒,燃烧不一定需要氧气