��Ŀ����
����Ŀ����ѧ��Ӧ���������������������������
��1��Aѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������200mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 688 | 810 | 860 |
�ٷ�Ӧ��������ʱ�����____________����0��1��1��2��2��3��3��4��4��5��min��ԭ����____________��
����2��3minʱ����������Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ____________��������Һ������䣩
��2��Bѧ��Ҳ��ͬ����ʵ�飬�����ڷ�Ӧ̫�죬�ⲻ�������������취���ͷ�Ӧ���ʣ��������ѡ���������м�������____________�Լ�����Ӧ���ʡ�����д���ţ�
A������B��HNO3��ҺC��CuSO4��Һ
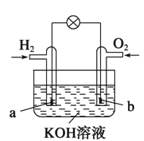
��3��CͬѧΪ��̽��Fe3����Cu2����H2O2�ֽ�Ĵ�Ч�����������ͼ��ʾ��ʵ�顣��ͨ���۲�___________________________�����ԱȽϵó����ۡ���ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ��������������__________________________��
���𰸡�2��3 ��÷�Ӧ���ȣ����ŷ�Ӧ����Һ�¶����ߣ��ʷ�Ӧ���ʼӿ� 0.2mol��L-1��min-1 A ��Ӧ�������ݵĿ��� ������������ͬ���ų������ӵĸ���
��������
��1����λʱ�����������������Խ��Ӧ����Խ�죻п�����ᷴӦ���ȣ�
��2��3min���������������448mL����״���������ʵ�����![]() ��������������ʵ���0.4mol��
��������������ʵ���0.4mol��
��2������Ӱ�췴Ӧ���ʵ����ط�����
��3��˫��ˮ�ֽ������ݲ��������ݿ��Ʊ�������̽��Fe3����Cu2����H2O2�ֽ⣬������������ͬ��
��1�����ݱ������ݣ�2 min��3min�ռ���������࣬��Ӧ��������ʱ�����2��3min��п�����ᷴӦ���ȣ����ŷ�Ӧ����Һ�¶����ߣ��ʷ�Ӧ���ʼӿ죻
��2��3min���������������448mL����״���������ʵ�����![]() ��������������ʵ���0.04mol��
��������������ʵ���0.04mol��![]() =0.2mol��L-1��min-1��
=0.2mol��L-1��min-1��
��2��A��������飬�¶Ƚ��ͣ���Ӧ���ʼ�������ѡA��
B������HNO3��Һ��������п��Ӧ���������������ʲ�ѡB��
C������CuSO4��Һ��п�û���ͭ������ԭ��أ���Ӧ���ʼӿ죬�ʲ�ѡC��
��3��˫��ˮ�ֽ������ݲ�������ͨ���۲췴Ӧ�������ݵĿ��������ԱȽϴ�Ч�������ݿ��Ʊ�������̽��Fe3����Cu2����H2O2�ֽ⣬������������ͬ���ų������ӵĸ��ţ�����FeCl3��ΪFe2(SO4)3��Ϊ������

����Ŀ�����и���ʵ����ʵ�ó��Ľ��۴�����ǣ� ��
ʵ����ʵ | ���� | |
A. | ij��Һ�м���BaCl2��Һ�а�ɫ�������� | ����Һ��һ������SO42- |
B. | ����ʱ��ͭ����Ũ���ᷴӦ | Ũ������ǿ������ |
C. | ij��ɢϵ���ж����ЧӦ | �÷�ɢϵ�ǽ��� |
D. | Al(OH)3���������ᷴӦ��Ҳ����NaOH��Һ��Ӧ | Al(OH)3�������������� |
A.AB.BC.CD.D