题目内容
【题目】工业上制硫酸的主要反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2 2SO2+O2
2Fe2O3+8SO2 2SO2+O2 2SO3 SO3+H2O=H2SO4。煅烧2.5t含85%FeS2的黄铁矿石(杂质不参加反应)时,FeS2中的S有5.0%损失而混入炉渣,计算可制得98%硫酸的质量_________。
2SO3 SO3+H2O=H2SO4。煅烧2.5t含85%FeS2的黄铁矿石(杂质不参加反应)时,FeS2中的S有5.0%损失而混入炉渣,计算可制得98%硫酸的质量_________。
【答案】3.36t
【解析】
根据化学方程式,可以找出下列关系:FeS2~2SO2~2SO3~2H2SO4,从FeS2制H2SO4,是同种元素转化的多步反应,即理论上FeS2中的S全部转变成H2SO4中的S,得关系式FeS2~2H2SO4。过程中的损耗认作第一步反应中的损耗,得可制得98%硫酸的质量。
根据化学方程式,可以找出下列关系:FeS2~2SO2~2SO3~2H2SO4,从FeS2制H2SO4,是同种元素转化的多步反应,即理论上FeS2中的S全部转变成H2SO4中的S,得关系式FeS2~2H2SO4。过程中的损耗认作第一步反应中的损耗,
令生成硫酸xt,则
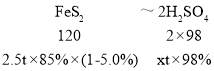
![]()
解得x=3.36
故答案为:3.36t。

练习册系列答案
相关题目