题目内容
6.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,下列说法正确的是( )| A. | 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 | |
| B. | 1 mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270 kJ | |
| C. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
分析 A、反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应;
B、液态氟化氢的能量比气态氟化氢的能量低,根据反应热与能量关系判断;
C、由热化学方程式可知2mol氟化氢气体分解成1mol的氢气和1mol的氟气吸收270kJ热量;
D、热化学方程式中化学计量数表示物质的量,不表示分子个数.
解答 解:A、反应为放热反应,在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量,故A正确;
B、液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于270kJ,故B错误;
C、由热化学方程式可知2mol氟化氢气体分解成1mol的氢气和1mol的氟气吸收270kJ热量,化学计量数表示物质的量,不是体积,故C错误;
D、热化学方程式中化学计量数表示物质的量,不表示分子个数,故D错误.
故选A.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,难度不大,注意反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强 | |
| B. | 第 VIIA族元素从上到下,其氢化物的还原性依次减弱 | |
| C. | 同周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
17.化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A. | 苯酚钠溶液与少量的CO2反应的离子方程式:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(g);△H=-571.6 KJ•mol-1 |
1.释放能量的化学反应一定是( )
| A. | 断开反应物中化学键吸收的能量比形成生成物中化学键放出的能量大 | |
| B. | 断开旧键吸收的能量大于形成新键所放出的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应物的总能量低于生成物的总能量 |
15.某无色溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是( )
| A. | Ca2+、H+、Cl-、CO32- | B. | K+、Cl-、SO42-、SO32- | ||
| C. | K+、OH-、SO32-、MnO4- | D. | H+、Al3+、Mg2+、Cl- |
16.F2与水反应的化学方程式2F2+2H2O═4HF+O2,在反应中水( )
| A. | 是还原剂 | B. | 是氧化剂 | ||
| C. | 是还原剂既是氧化剂又是还原剂 | D. | 既不是氧化剂又不 |
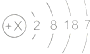 A、B、C、D、E为原子序数依次增大的五种短周期元素.已知:A、D同主族,且A元素原子的最外层电子数是次外层电子数的两倍;B元素为短周期是最活泼的金属元素;C元素阳离子C3+的电子层结构与Ne相同;元素E与右图原子结构示意图所对应元素M处于同一主族.根据要求回答下列问题.
A、B、C、D、E为原子序数依次增大的五种短周期元素.已知:A、D同主族,且A元素原子的最外层电子数是次外层电子数的两倍;B元素为短周期是最活泼的金属元素;C元素阳离子C3+的电子层结构与Ne相同;元素E与右图原子结构示意图所对应元素M处于同一主族.根据要求回答下列问题. .
.