��Ŀ����
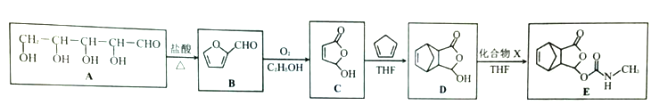
����Ŀ��(1)��֪NO2��N2O4�Ľṹʽ����ͼ��ʾ����֪��N��N�ļ���Ϊa kJ/mol��NO2��N2O4��N=O�����ֱܷ���b kJ/mol��c kJ/mol��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ________________����H��a��b��c�Ĵ���ʽ��ʾ����
(2)��100��ʱ����0.4mol NO2����2L����������з�����Ӧ��2NO2![]() N2O4�������������������ʵ�����ʱ��仯���±���
N2O4�������������������ʵ�����ʱ��仯���±���
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�����������£�ǰ20s����NO2��ʾ��ƽ����ѧ��Ӧ����Ϊ_________________________���ﵽƽ��״̬ʱ��NO2��ת������________��
��n2_______ n3(����>������=������<��)��
��80sʱ���������ڼ���NO2��N2O4��0.24mol����ѧƽ�⽫_________(����������Ӧ�����ƶ������� ���淴Ӧ�����ƶ����������ƶ���)��
������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬������ʼʱ����Ҫ����������N2O4���壬��N2O4��Ũ��Ϊ_____________��
���𰸡� 2NO2(g) =N2O4(g) ��H = (4b-a-4c) kJ/mol����2NO2(g) N2O4(g) ��H = -(a+4c-4b) kJ/mol�� 0.0025mol/(L��s) 40% < ���ƶ� 0.05mol/L
��������(1)��Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ����NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ2NO2(g)=N2O4(g) ��H=(4b��a��4c)kJ��mol��1��(2)��ǰ20s������N2O4��0.05mol�����ݷ���ʽ��֪����NO2��0.1mol��Ũ����0.05mol/L������NO2��ʾ��ƽ����ѧ��Ӧ����Ϊ0.05mol/L��20s��0.0025mol/(L��s)���ﵽƽ��״̬ʱ������N2O4��0.08mol������NO2��0.16mol������NO2��ת������0.16mol/0.4mol��100%��40%����n2��(0.4mol��0.26mol)/2��0.07mol��n3��0.4mol��0.08mol��2��0.24mol�����n2��n3����80sʱ��Ӧ�ﵽƽ��״̬��ƽ�ⳣ��K��![]() ���������м���NO2��N2O4��0.24mol����ʱŨ����Q��
���������м���NO2��N2O4��0.24mol����ʱŨ����Q��![]() �����Ի�ѧƽ�ⲻ�ƶ���������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬����ת����NO2Ӧ������0.4mol�������ҪN2O4ת������0.2molNO2��������ҪN2O40.1mol��Ũ����0.05mol/L��
�����Ի�ѧƽ�ⲻ�ƶ���������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬����ת����NO2Ӧ������0.4mol�������ҪN2O4ת������0.2molNO2��������ҪN2O40.1mol��Ũ����0.05mol/L��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���( )
ѡ�� | �� | �� | �� | ʵ����� | ʵ��װ�� |
A | ϡ���� | Na2S | AgNO3��AgCl����Һ | Ksp(AgCl)��Ksp(Ag2S) |
|
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | ϡ���� | Na2SO3 | Ba(NO3)2 ��Һ | SO2������Ա��ξ��������ɰ�ɫ���� | |
D | Ũ���� | Na2CO3 | Na2SiO3��Һ | ���ԣ����̼����� |
A. A B. B C. C D. D