��Ŀ����
����Ŀ����ͼ1Ϊʵ������ȡ������ʵ��װ�á�
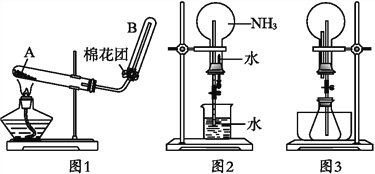
��1��д��A����������Ӧ�Ļ�ѧ����ʽ_______________________��Ҫ�ռ�����İ�����������____________________���������
��2�����ռ�����ʱ�Թܿ�����������___________��
��3��һλѧ�����Ƶõİ���,��ͼ2װ�ý�����Ȫʵ��,��ƿ�ѳ�������İ���,������Ȫʵ��IJ�����___________��
��4����һѧ������˼��������Ȫ����������,�����ͼ3װ�á���������ƿ�зֱ������������������,��Ӧ���ܲ�����Ȫ����___________��
A.CaCO3��ĩ��Ũ���� B.NH4HCO3��Һ��ϡNaOH��Һ
C.HCl��AgNO3��Һ D.HCl����ɫ��̪��Һ
��ͬѧ������ƿ�м���ƾ�,ˮ���м�����ˮ��,�ټ�����������������,���Ҳ��������Ȫ��ˮ���м�������ʿ�����___��
A.����� B.ʳ�� C.Ũ���� D.����ͭ
��5�����鰱���ѳ����Թ�B�ķ�����______________��
��6�����Ƶñ�״���µİ���2.24L����Ӧ��������Ҫ��ʯ��______g
���𰸡� 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O ��ʯ�ң������NaOH��CaO�� ����������Ķ���,��֤�Թ������ռ������� ����Ƥ�ܵļ���,��ѹ��ͷ�ιܵĽ�ͷ,ʹ������ˮ������ƿ A C ��ʪ�����ɫʯ����ֽ����B�Թܿڣ���ֽ����֤������������������Ҳ���֣� 3.7g
CaCl2+2NH3��+2H2O ��ʯ�ң������NaOH��CaO�� ����������Ķ���,��֤�Թ������ռ������� ����Ƥ�ܵļ���,��ѹ��ͷ�ιܵĽ�ͷ,ʹ������ˮ������ƿ A C ��ʪ�����ɫʯ����ֽ����B�Թܿڣ���ֽ����֤������������������Ҳ���֣� 3.7g
����������1�����õ��ǹ�+�̻�ϼ��������ķ����������Ȼ�狀��������ƹ����ϼ�����NH3���Ȼ�����������Ʒ�Ӧ�����Ȼ��ơ�������ˮ����Ӧ�Ļ�ѧ����ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��Ҫ�ռ�����İ����������ü�ʯ�ң������NaOH��CaO�������������2���ռ������õ��������ſ��������Թܿ����������Ǽ��ٰ���������Ķ������ӿ��ռ������ʣ�ͬʱ��֤�Թ������ռ�����������3��������������ˮ�������ֹˮ�У���������ˮ����ƿ��ѹǿѸ�ټ�С�����γ���Ȫ���ʴ�Ϊ������Ƥ�ܵļ��ӣ���ѹ��ͷ�ιܵĽ�ͷ��ʹ������ˮ������ƿ����4��CaCO3��ĩ��Ũ���ᷴӦ��������������̼��ʹ��ƿ��ѹǿ�����γ���Ȫ��ѡ��A��ȷ��B��NH4HCO3��Һ��ϡNaOH��Һ�����������壬�����γ���Ȫ��ѡ��B����C��HCl��AgNO3��Һ�����������壬�����γ���Ȫ��ѡ��C����D��HCl�ͷ�̪��Һ�����������壬�����γ���Ȫ��ѡ��D����ѡA��
CaCl2+2NH3��+2H2O��Ҫ�ռ�����İ����������ü�ʯ�ң������NaOH��CaO�������������2���ռ������õ��������ſ��������Թܿ����������Ǽ��ٰ���������Ķ������ӿ��ռ������ʣ�ͬʱ��֤�Թ������ռ�����������3��������������ˮ�������ֹˮ�У���������ˮ����ƿ��ѹǿѸ�ټ�С�����γ���Ȫ���ʴ�Ϊ������Ƥ�ܵļ��ӣ���ѹ��ͷ�ιܵĽ�ͷ��ʹ������ˮ������ƿ����4��CaCO3��ĩ��Ũ���ᷴӦ��������������̼��ʹ��ƿ��ѹǿ�����γ���Ȫ��ѡ��A��ȷ��B��NH4HCO3��Һ��ϡNaOH��Һ�����������壬�����γ���Ȫ��ѡ��B����C��HCl��AgNO3��Һ�����������壬�����γ���Ȫ��ѡ��C����D��HCl�ͷ�̪��Һ�����������壬�����γ���Ȫ��ѡ��D����ѡA��
��ƿ��װ�оƾ����ӷ���Ҫ�γ���Ȫ��Ӧʹ��ƿ��ѹǿ������������Ӧ�ų��������ȣ�Ũ������ˮ��ϡ�ͣ��ͷų��������ȣ�ʹ��ƿ�е��Ҵ��ӷ���ѹǿ�����γ���Ȫ�����������ʶ����ܴﵽ����ˮ���ų��������ȵ�Ŀ�ģ�ֻ��C���ϣ���ѡC����5�����鰱���ѳ����Թ�B�ķ�������ʪ��ĺ�ɫʯ����ֽ����B�Թܿڣ���ֽ����֤����������6�����Ƶñ�״���µİ���2.24L�����ݷ�Ӧ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O����������Ҫ��ʯ��
CaCl2+2NH3��+2H2O����������Ҫ��ʯ��![]() g��
g��

����Ŀ��ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+ �� ���ֺ�̽���������£�
�������ữ��0.05molL��1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ��������������֤����ɫ�����к���Ag��
��ȡ�ϲ���Һ���μ�K3[Fe��CN��6]��Һ��������ɫ������˵����Һ�к��� ��
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ����Fe3+ �� ����Ϊ���۹���ʱ��������Fe3+ �� �����ݵ�ԭ�����������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⣮ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3minʱ��С����Һ��ɫ��3minʱ���� |
�� | 120 | ������ɫ��������30minʱ��С����Һ��ɫ��3 0minʱ��dz |
�����ϣ�Ag+��SCN�����ɰ�ɫ����AgSCN��
�ڶ�Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2 �� �����������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3�����������ԣ��ɲ���Fe3+��
����d�����������ж���Һ�д���Ag+ �� �ɲ���Fe3+ ��
������ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ����Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3minʱ��Һ��dz��ɫ��30min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ�� �� ���������� �� 
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡������Fe3+Ũ�ȱ仯��ԭ�� ��
