��Ŀ����
����Ŀ���������仯�����ڹ�ũҵ�����о��й㷺����;��ũҵ�Ի��ʵ������Ǻϳɰ���ҵ��չ�ij־��ƶ�����ijС����й�ҵ�ϳɰ�N2(g)+3H2(g)![]() 2NH3(g) ��H��0��ģ���о�����2L�ܱ������У�������ϵ���¶�600�治�䣬�ֱ����0.2mol N2��0.6mol H2��ʵ��a��b��c��c(N2)��ʱ�䣨t���ı仯����ͼ��ʾ��
2NH3(g) ��H��0��ģ���о�����2L�ܱ������У�������ϵ���¶�600�治�䣬�ֱ����0.2mol N2��0.6mol H2��ʵ��a��b��c��c(N2)��ʱ�䣨t���ı仯����ͼ��ʾ��
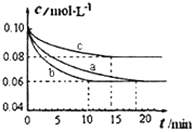
��1��ʵ��b�ӿ�ʼ����ƽ��״̬�Ĺ����У���H2��ʾ��ƽ����Ӧ����Ϊ______________��600��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ____________������������һλС������
��2����ʵ��a��ȣ�ʵ��b�����õ�ʵ����������Ϊ________________������ĸ��ţ���ͬ����ʵ��c�����õ�ʵ����������Ϊ_________________��
A.����ѹǿ B.��Сѹǿ C.�����¶� D.ʹ�ô���
��3������������ʹ�÷�Ӧ�ķ�Ӧ���������������H2��ת���ʵ���___________
A.��ʱ��������� B.�ʵ�����ѹ C.����H2��Ũ�� D.ѡ���Ч����
��4�����º��������£������÷�Ӧ�ﵽ��ѧƽ��״̬�ı�־��___________
A. ��������ѹǿ���ٸı��״̬
B. ���������ܶȲ��ٸı��״̬
C. ��������ƽ����Է����������ٸı��״̬
������Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ�Ϻϳɼ״��ķ�Ӧԭ��Ϊ��CO��g��+2H2��g��CH3OH��g�� ��H��
�±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ٸ��ݱ������ݿ��жϡ�H___________0 �����������=����������
����300��ʱ����2mol CO��3mol H2��2mol CH3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��
Ӧ�� _____________������ĸ��ţ���
A�����������ƶ� B�����淽���ƶ� C������ƽ��״̬ D�����ж�
��2����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l�� ��H=-1451.6kJmol-1
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJmol-1
д���������¼״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_______________________ ��
��3���Լ״�������Ϊԭ�ϣ�KOH��Һ��Ϊ����ʹ���ȼ�ϵ���ܷ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O�����ĵ缫��ӦʽΪ___________________�����ŷ�Ӧ�IJ��Ͻ�����Һ��pH _____________���������С�����䡱����
��4������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ������������ĵ缫��ӦʽΪ____________________________��������һ��ʱ���NaCl��Һ�����Ϊ1L����Һ��pHΪ12��25���²ⶨ�������������������������Ϊ _______ mL������£�����ʱ��·��ͨ���ĵ�����Ϊ_________________________��
���𰸡� 0.012mol��L-1��min-1 18.3 D B B A ,C �� A CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJmol-1 �������10��CH3OH+8OH--6e-=CO32-+6H2O ��С 2Cl--2e-=Cl2�� 56 0.01NA(��6.02x1021)
��������(��)(1) ʵ��b�ӿ�ʼ����ƽ��״̬�Ĺ����У���N2��ʾ��ƽ����Ӧ����Ϊ![]() =0.004mol��L-1��min-1������H2��ʾ��ƽ����Ӧ����Ϊ3��0.004mol��L-1��min-1=0.012mol��L-1��min-1 ��
=0.004mol��L-1��min-1������H2��ʾ��ƽ����Ӧ����Ϊ3��0.004mol��L-1��min-1=0.012mol��L-1��min-1 ��
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼŨ��(mol/L) 0.10 0.30 0
�仯Ũ��(mol/L) 0.04 0.12 0.08
ƽ��Ũ��(mol/L) 0.06 0.18 0.08
600��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =18.3��
=18.3��
(2)����ͼ���֪b����ƽ���ʱ���a�̣�����ƽ��ʱN2��Ũ����a��ͬ����ѧƽ�ⲻ�ƶ�����b��a��ȼ��˴�������D��ȷ��a��c�ȽϿ�֪��c�����ʱ�aС��ƽ��ʱ������Ũ�ȸߣ���ƽ�������ƶ�����cΪ��С��ѹǿ����B��ȷ��
(3)����ѡ����������Ӧ���ʵĴ�ʩΪ�ʵ�����ѹǿ������H2��Ũ����ѡ���Ч�������������H2��ת���ʵ�ֻ���ʵ�����ѹǿ�����������ı�ת���ʣ�����H2��Ũ�Ƚ���H2��ת���ʣ��ʴ�ΪB��
(4)A. ������䣬�������������ʵ����Dz���ֵ�����������ѹǿ���ٸı��״̬��ƽ��״̬����A��ȷ��B. ��������ͻ�����������ʼ�ղ��䣬���������ܶȲ��ٸı��״̬����һ����ƽ��״̬����B����C. ������������ʼ�ղ��䣬�������������ʵ����Dz���ֵ����������ƽ����Է����������ٸı��״̬����ƽ��״̬����C��ȷ����ΪAC��
(��)(1)�����ݱ������ݷ��������¶����ߣ�ƽ�ⳣ����С��˵��ƽ�������������ӦΪ���ȷ�Ӧ����H��0��
����300��ʱ����2molCO��3molH2��2molCH3OH�����ݻ�Ϊ1L���ܱ������У�CO(g)+2H2(g)CH3OH(g)��Ũ����Q=![]() =
=![]() ��K=0.270����Ӧ������У��ʴ�ΪA��
��K=0.270����Ӧ������У��ʴ�ΪA��
(2)��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)��H=-1451.6kJmol-1
��2CO(g)+O2(g)=2CO2(g)��H=-566.0 kJmol-1
���ݸ�˹���ɼ���![]() �õ���CH3OH(l)+O2(g)=CO2(g)+2H2O(g)��H=[(-1451.6kJmol-1)-(-566.0 kJmol-1)]��
�õ���CH3OH(l)+O2(g)=CO2(g)+2H2O(g)��H=[(-1451.6kJmol-1)-(-566.0 kJmol-1)]��![]() =-442.8kJmol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH(l)+O2(g)=CO(g)+2H2O(l)��H=-442.8kJmol-1��
=-442.8kJmol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH(l)+O2(g)=CO(g)+2H2O(l)��H=-442.8kJmol-1��
(3)�Լ״�������Ϊԭ�ϣ�KOH��Һ��Ϊ�������Һ����ȼ�ϵ���ܷ�ӦΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O���״�ȼ�ϵ���м״��ڸ���ʧ���ӷ���������Ӧ������Һ������̼���Σ������缫��ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O�����ŷ�Ӧ�IJ��Ͻ�����Һ��pH��С��
(4)��ⱥ��ʳ��ˮ������������������������Ӧ�����������缫��ӦʽΪ��2Cl--2e-=Cl2�������һ��ʱ�䣬��Һ��pH=12������Һ��c(OH-)=0.01mol/L����n(OH-)=0.01mol/L��1L=0.01mol�����ݷ�Ӧ2NaCl+2H2O=H2��+Cl2��+2NaOH��֪��n(Cl2)=0.01mol��![]() =0.005mol�����ݵ���ת���غ���4n(O2)=2n(Cl2)������n(O2)=
=0.005mol�����ݵ���ת���غ���4n(O2)=2n(Cl2)������n(O2)= ![]() =0.0025mol����ԭ����������������Ϊ0.0025mol��22.4L/mol=0.056L=56mL��ת�Ƶ�����Ϊn(O2)��4=0.0025mol��4=0.01NA=6.02x1021��
=0.0025mol����ԭ����������������Ϊ0.0025mol��22.4L/mol=0.056L=56mL��ת�Ƶ�����Ϊn(O2)��4=0.0025mol��4=0.01NA=6.02x1021��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

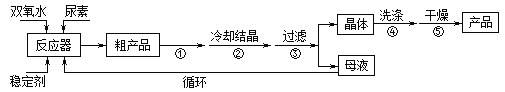
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����








