题目内容
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
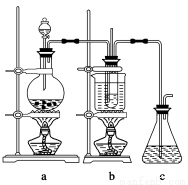
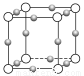
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH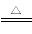 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
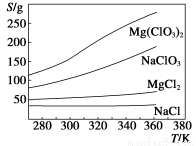
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
(1)①MnO2+4H++2Cl-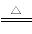 Mn2++Cl2↑+2H2O ②石灰乳来源丰富、价格便宜、成本低 ③3NaClO
Mn2++Cl2↑+2H2O ②石灰乳来源丰富、价格便宜、成本低 ③3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
(2)②趁热过滤,取滤液 ③冷却结晶、过滤、洗涤沉淀
(3)3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2 除去混在氯酸镁晶体中的少量NaCl
【解析】(2)根据溶解度曲线,加热蒸发,析出MgCl2、NaCl固体,趁热过滤,然后将滤液冷却结晶即得Mg(ClO3)2·6H2O晶体;由于Mg(ClO3)2·6H2O中含有少量NaCl,可采取重结晶的方法。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案大气中的部分碘源于O3对海水中I-的氧化,将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(aq)  HOI(aq)ΔH2
HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)  I2(aq)+H2O(l)ΔH3
I2(aq)+H2O(l)ΔH3
总反应的化学方程式为____________________,其反应热ΔH=__________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3—(aq),
I3—(aq),
其平衡常数表达式为______________。
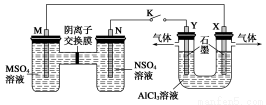
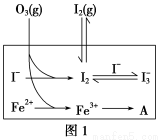
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3—浓度和体系pH,结果见图2和下表。
 、
、
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________________________。
②图1中的A为__________,由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________________________________________________。
③第2组实验进行18 s后,I3—浓度下降,导致下降的直接原因有(双选)________(填字母序号)。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
| 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
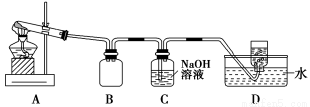
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。