题目内容
【题目】酪醇是合成药物的中间体。由芳香化合物A为原料制备酪醇的一种合成路线如图:
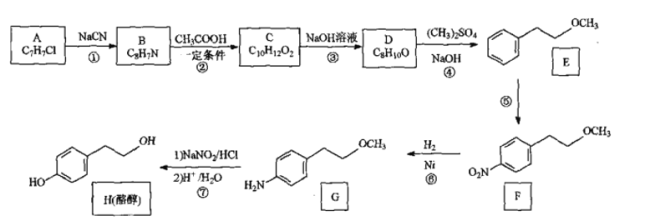
已知:
回答下列回题:
(1)B的结构简式为_____________________。
(2)F中的官能团的名称为__________________。
(3)写出C→D的化学方程式:___________________________。
(4)反应④的反应类型是_______________________________。
(5)反应⑤所需的试剂和条件是_________________________________。
(6)C的一种同分异构体,能发生银镜反应和水解反应,其核磁共振氢谱有4组峰,面积比为6:3:2:1,写出一种符合要求的同分异构体的结构简式:_____________。
(7)已知: ![]() (苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
(苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
【答案】![]() 硝基、醚键
硝基、醚键 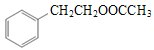 +NaOH
+NaOH![]()
![]() +CH3COONa 取代反应 浓硝酸、浓硫酸、加热
+CH3COONa 取代反应 浓硝酸、浓硫酸、加热 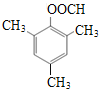 或
或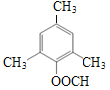
【解析】
根据E的结构简式可知A中有苯环,且只有一个取代基,又由于A的分子式为C7H7Cl,所以可以确定A为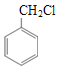 ,和NaCN反应生成B(C8H7N),根据A和B的分子式的差别,可知A中的Cl被氰基取代生成了
,和NaCN反应生成B(C8H7N),根据A和B的分子式的差别,可知A中的Cl被氰基取代生成了![]() ,B和醋酸反应,发生的是已知给出的反应,生成的C为
,B和醋酸反应,发生的是已知给出的反应,生成的C为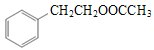 ,C发生了碱性水解,得到的D为
,C发生了碱性水解,得到的D为![]() ,D发生取代反应生成E
,D发生取代反应生成E![]() ,E发生硝化反应生成F
,E发生硝化反应生成F ,F发生还原反应,硝基被还原为氨基,得到G
,F发生还原反应,硝基被还原为氨基,得到G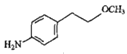 ,G再发生取代反应生成酪醇H。
,G再发生取代反应生成酪醇H。
(1)由以上分析可知,B的结构简式为![]() 。
。
(2)F为 ,官能团为硝基和醚键。
,官能团为硝基和醚键。
(3)C发生了碱性水解,得到D,化学方程式为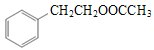 +NaOH
+NaOH![]()
![]() +CH3COONa。
+CH3COONa。
(4)反应④是D中的羟基上的氢原子被甲基取代,所以反应类型是取代反应。
(5)反应⑤是硝化反应,所需的试剂是浓硝酸,条件是浓硫酸、加热。
(6)C的分子式为C10H12O2,不饱和度为5。它的一种同分异构体,能发生银镜反应和水解反应,分子中应有醛基和酯基,C只有2个氧原子,所以应为甲酸酯,其核磁共振氢谱有4组峰,面积比为6:3:2:1,分子中应有对称的甲基,符合要求的同分异构体可以是 或
或 。
。
(7)甲苯可以硝化得到2,4,6-三硝基甲苯,甲基可以被酸性高锰酸钾溶液氧化为羧基,硝基被还原为氨基,再被羟基取代即可得到2,4,6一三羟基苯甲酸。需要注意的是甲基的氧化和硝基的还原的顺序,由于 ![]() (苯胺)易被氧化,所以应先氧化甲基。若先还原硝基,氨基在氧化甲基时也会被氧化。故合成路线为
(苯胺)易被氧化,所以应先氧化甲基。若先还原硝基,氨基在氧化甲基时也会被氧化。故合成路线为 。
。

【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。