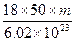题目内容
(14分)某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
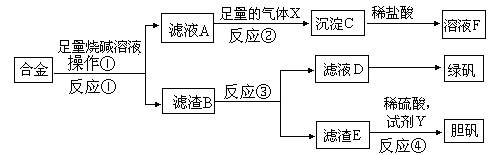
请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______

请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
| 实验编号 | 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 1 | 11.2g | 25.1g | 19.2g |
| 2 | 11.2g | 25.1g | 18.8g |
| 3 | 11.2g | 25.1g | 18.9g |
(1)AlO2- + CO2 + 2H2O= Al(OH)3↓+ HCO3-
(2)Cu + H2O2 + H2SO4 + 3H2O = CuSO4·5H2O或Cu+H2O2 + H2SO4 = CuSO4 + 2H2O
(3)因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解进行到底,因此得不到FeCl3?6H2O晶体
(4)①c (2) ②防止加热中Fe2+被氧化;③n1-n2≤0.1g, ④7
(2)Cu + H2O2 + H2SO4 + 3H2O = CuSO4·5H2O或Cu+H2O2 + H2SO4 = CuSO4 + 2H2O
(3)因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解进行到底,因此得不到FeCl3?6H2O晶体
(4)①c (2) ②防止加热中Fe2+被氧化;③n1-n2≤0.1g, ④7
三种金属中只有铝能与碱反应生成NaAlO2、通过足量CO2后生成Al(OH)3溶液与NaHCO3。易知E是铜,铜与稀硫酸不反应,故Y有较强的氧化性,结合其为液体知为H2O2;D是FeSO4,可用NaOH 来检验Fe2+。FeCl3是挥发性酸的弱碱盐,直接加热盐溶液时能促使水解进行到底。
应先称量坩埚质量,再称坩埚与药品质量和;亚铁盐在温度较高的条件很易被空气氧化,故应放在氮气流中进行实验;当再次称量数据与第n1相差不超过0.1g时表明符合要求。因2、3两次称量结果相近而第一次与另外两次相差较大,故用2、3两次称量结果的平均值进行计算。
应先称量坩埚质量,再称坩埚与药品质量和;亚铁盐在温度较高的条件很易被空气氧化,故应放在氮气流中进行实验;当再次称量数据与第n1相差不超过0.1g时表明符合要求。因2、3两次称量结果相近而第一次与另外两次相差较大,故用2、3两次称量结果的平均值进行计算。

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目


 ×6.02×1023
×6.02×1023 ×6.02×1023
×6.02×1023