题目内容
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH =7.8, 已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
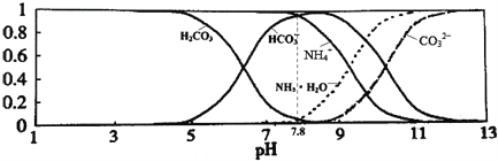
A. 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. 通过分析可知常温下 :Kb(NH3·H2O)<Ka1(H2CO3)
D. 在此溶液中滴加少量浓盐酸,溶液中c(CO32-) / c(HCO3-)减小
【答案】C
【解析】A项,由图知溶液的pH=9时,溶液中粒子浓度由大到小的顺序为c(HCO3-)![]() c(NH4+)
c(NH4+)![]() c(NH3·H2O)
c(NH3·H2O)![]() c(CO32-),正确;B项,NH4HCO3溶液中NH4+存在水解平衡,HCO3-既存在水解平衡又存在电离平衡,则NH4HCO3溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;C项,常温下0.1mol/LNH4HCO3溶液的pH=7.8,溶液呈碱性,说明HCO3-的水解程度大于NH4+的水解程度,则Kb(NH3·H2O)
c(CO32-),正确;B项,NH4HCO3溶液中NH4+存在水解平衡,HCO3-既存在水解平衡又存在电离平衡,则NH4HCO3溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;C项,常温下0.1mol/LNH4HCO3溶液的pH=7.8,溶液呈碱性,说明HCO3-的水解程度大于NH4+的水解程度,则Kb(NH3·H2O)![]() Ka1(H2CO3),错误;D项,溶液中存在电离平衡HCO3-
Ka1(H2CO3),错误;D项,溶液中存在电离平衡HCO3-![]() H++CO32-,该电离平衡常数=
H++CO32-,该电离平衡常数=![]() ,溶液中滴加少量浓盐酸,c(H+)增大,电离平衡常数不变,溶液中c(CO32-)/c(HCO3-)减小,正确;答案选C。
,溶液中滴加少量浓盐酸,c(H+)增大,电离平衡常数不变,溶液中c(CO32-)/c(HCO3-)减小,正确;答案选C。

【题目】LiFePO4电池广泛用于电动车。电池反应:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
选项 | 放电过程 | 充电过程 |
A | Li+向电池的正极迁移 | 化学能转化成电能 |
B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-=FePO4+Li+ |
C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-=Li |
A. A B. B C. C D. D
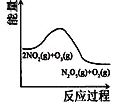
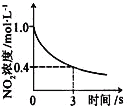
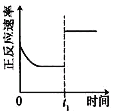
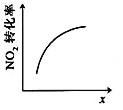
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
升高温度,化学平衡常数增大 | 0~3秒内,反应速率 V(O3)= 0.1mol·L-1·s-1 | 加入催化剂,平衡向正反应方向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. A B. B C. C D. D