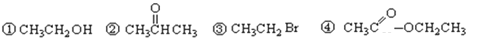题目内容
【题目】LiFePO4电池广泛用于电动车。电池反应:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列说法正确的是
选项 | 放电过程 | 充电过程 |
A | Li+向电池的正极迁移 | 化学能转化成电能 |
B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-=FePO4+Li+ |
C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-=Li |
A. A B. B C. C D. D
【答案】D
【解析】A、充电过程是电能转化成化学能的过程,故A错误;B、Li属于活泼金属,加入磷酸,Li会与磷酸反应,故B错误;C、根据原电池的工作原理,电子从负极经外电路流向正极,电子不通过电解质,故C错误;D、负极反应式为:Li-e-=Li+,转移nmolLi+,说明通过电子物质的量为nmol,即Li失去电子nmol,充电时,电池的负极接电源的负极,即阴极反应式为Li++e-=Li,故D正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目