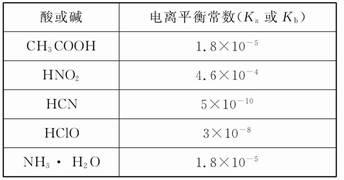
��Ŀ����
ij��ѧѧϰС��Ϊ�о�HA��HB��MOH������Ե����ǿ��,�������ʵ��:�����½�pH=2����������ҺHA��HB��pH=12��MOH����Һ��1 mL,�ֱ��ˮϡ�͵�1 000 mL,��pH�ı仯����Һ����Ĺ�ϵ��ͼ,��������������,��ش���������: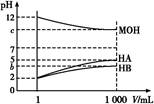
(1)HAΪ ��,HBΪ ��(�ǿ��������)��
(2)��c=9,��ϡ�ͺ��������Һ��,��ˮ�����������Ũ�ȵĴ�С˳��Ϊ (���ᡢ�ѧʽ��ʾ)��
(3)��c=9,��ϡ�ͺ��HA��Һ��MOH��Һȡ��������,��������Һ��c(A-)��c(M+)�Ĵ�С��ϵΪc(A-) (����ڡ�����С�ڡ����ڡ�)c(M+)��
(4)��b+c=14,��MOHΪ ��(�ǿ��������)����ϡ�ͺ��HB��Һ��MOH��Һȡ��������,���û����Һ��pH 7(����ڡ�����С�ڡ����ڡ�)��
(1)ǿ �� (2)MOH=HA��HB
(3)���� (4)�� ����
����

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO(��FeO��CuO)�Ʊ�����ZnO����������(��֪����ʽ̼��п�����տ��Ƶû���ZnO)��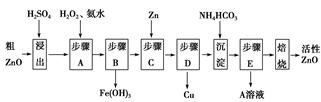
��֪�������������������������ʱ��pH�����
| ���������� | Fe2�� | Fe3�� | Zn2�� | Cu2�� |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
��ش��������⣺
(1)����A��H2O2������Ӧ�����ӷ���ʽ�� ���ò����������ҺpH�ķ�Χ�� ��
(2)A��Һ����Ҫ���е������� ��
(3)��ʽ̼��п�������Ƶû���ZnO�ķ�Ӧ��H��0���÷�Ӧ���Է����е�ԭ���Ǧ�S (ѡ�����������������)0��
(4)����������ķ�ˮpH��8����ʱZn2����Ũ��Ϊ mg/L(�����£�Ksp[Zn(OH)2]��1.2��10��17)��
������,��ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ��������,������Һ�����ʵ���Ũ�Ⱥͻ����Һ��pH�����ʾ:
| ʵ���� | HA�����ʵ� ��Ũ��(mol��L-1) | NaOH�����ʵ� ��Ũ��(mol��L-1) | ��Ϻ��� Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.12 | 0.1 | pH=7 |
| �� | 0.2 | 0.1 | pH>7 |
| �� | 0.1 | 0.1 | pH=10 |
(1)�Ӽ����������,����ж�HA��ǿ�ỹ������?
(2)��������Һ������Ũ��c(A-)��c(Na+)�Ĵ�С��ϵ�������� ����
A.ǰ�ߴ� B.���ߴ� C.������� D.���ж�
(3)�ӱ���ʵ��������,�û����Һ������Ũ���ɴ�С��˳������ ��
(4)��������ʵ������,д���û����Һ��������ʽ�ľ�ȷ���(��ʽ):
c(Na+)-c(A-)=����������������mol��L-1��
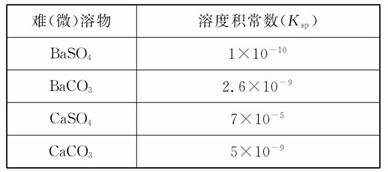
25 ��ʱ,����ƽ�ⳣ��:
| ����Ļ�ѧʽ | CH3COOH | HClO | H2CO3 |
| ����ƽ�ⳣ��(25 ��) | 1.8��10-5 | 3.0��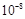 | K1=4.3��10-7 K2=5.6��10-11 |
�ش���������:
(1)���ʵ���Ũ��Ϊ0.1 mol/L��������������:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH�ɴ�С��˳��������������������(����)��
(2)������0.1 mol/L��CH3COOH��Һ��ˮϡ������,���б���ʽ������һ����С������������;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)��c(OH-) D.c(OH-)/c(H+)
(3)���Ϊ10 mL pH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1 000 mL,ϡ����pH�仯��ͼ,��HX�ĵ���ƽ�ⳣ����������(����ڡ��������ڡ���С�ڡ�)�����ƽ�ⳣ��;�������� ��,
ϡ�ͺ�,HX��Һ��ˮ���������c(H+)��������(����ڡ��������ڡ���С�ڡ�)������Һ��ˮ���������c(H+),�������� ;
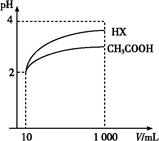
(4)25 ��ʱ,CH3COOH��CH3COONa�Ļ����Һ,����û��ҺpH=6,����Һ��c(CH3COO-)-c(Na+)=������������������������(��ȷ��ֵ)��

 mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n��
mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n��