题目内容
1.如图是298K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )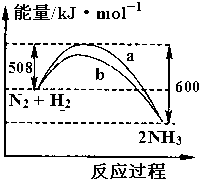
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
分析 A、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量-吸收的能量分析;
B、根据可逆反应的特点分析;
C、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
D、根据合成氨的反应伴随的能量变化来回答.
解答 解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g),△H=-92kJ•mol-1,故A错误;
B、向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ<92.4kJ,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故C正确;
D、合成氨的反应是放热反应,反应实质是旧键断裂和新键生成,前者吸收能量,后者释放能量,所以反应物的键能之和小于生成物的键能,故D错误.
故选C.
点评 本题考查了化学反应中能量转化与催化剂的关系,热化学方程式的书写,图象的应用能力,难度不大,注意化学平衡的特征是可逆反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.t℃时,将a g NH3完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3(ρ<1),溶质的质量分数为w,且其中n(NH${\;}_{4}^{+}$)为bmol.下列叙述中错误的是( )
| A. | 溶液中c(OH-)=$\frac{1000b+c(H+)V}{V}$ mol/L | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol/L | |
| C. | 溶质的质量分数w=$\frac{a}{ρV-a}$×100% | |
| D. | 向上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5w |
13.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇在电池的负极放电生成CO2时,共失去12mol 电子 | |
| B. | 1mol/L碳酸钠溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1mol | |
| C. | 25℃时,1L pH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| D. | 电解精炼铜,当电路中转移NA个电子,阳极溶解的铜<32g,阴极析出铜32g |
9.下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是( )
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是( )
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
10.在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g)?2Z(g),并达到平衡.已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
| A. | 若X的反应速率为0.2 mol•L-1•s-1,则Z的反应速率为0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |

 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.