题目内容
【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
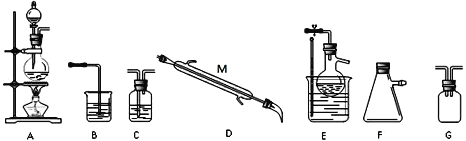
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________
【答案】![]() 直形冷凝管 C、E、D、F 饱和食盐水 吸收尾气中氯气,避免污染环境 3Cl2+NH4Cl=NCl3+4HCl 71℃~95℃ 用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的
直形冷凝管 C、E、D、F 饱和食盐水 吸收尾气中氯气,避免污染环境 3Cl2+NH4Cl=NCl3+4HCl 71℃~95℃ 用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的
红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色
【解析】
题干信息显示,利用氯气与氯化铵溶液反应制备三氯化氮,所以制得的氯气不必干燥,但须除去氯化氢,以防干扰三氯化氮的制备。先用A装置制取Cl2,然后经过安全瓶G防止倒吸,再利用C装置除去Cl2中混有的HCl;此时混有少量水蒸气的Cl2进入E装置与蒸馏烧瓶中加入的氯化铵溶液反应,生成三氯化氮和氯化氢;当E装置的烧瓶中出现较多油状液体时停止反应,用水浴加热蒸馏烧瓶,并控制温度在三氯化氮的沸点与95℃(爆炸点)之间,将三氯化氮蒸出,用D冷凝,用F承接;由于Cl2可能有剩余,所以需使用装置B进行尾气处理。
(1)NCl3为共价化合物,N原子与Cl各形成一对共用电子,其电子式为![]() ;仪器 M 的名称是直形冷凝管。答案为:
;仪器 M 的名称是直形冷凝管。答案为:![]() ;直形冷凝管;
;直形冷凝管;
(2)依据分析,如果气流的方向从左至右,装置连接顺序为A、G、C、E、D、F、B。答案为:C、E、D、F;
(3)装置C用于除去Cl2中混有的HCl,所以C中试剂是饱和食盐水;最后所得尾气中可能混有污染环境的Cl2,应除去,由此确定B装置的作用是吸收尾气中氯气,避免污染环境。答案为:饱和食盐水;吸收尾气中氯气,避免污染环境;
(4)E装置中,氯气与氯化铵溶液反应,生成三氯化氮和氯化氢,化学方程式为3Cl2+NH4Cl=NCl3+4HCl。答案为:3Cl2+NH4Cl=NCl3+4HCl;
(5)由以上分析可知,水浴加热温度应控制在三氯化氮的沸点与95℃(爆炸点)之间,应为71℃~95℃。答案为:71℃~95℃;
(6)设计实验时,应能证明现象来自产物,而不是反应物,所以使用的物质应与反应物不反应,但能与两种产物反应,且产生不同的现象,可设计为:用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色。答案为:用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色。

【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。回答下列问题:
(1)乙烷可通过热裂解和氧化裂解制取乙烯。已知下列键能数据:
化学键 | C—C | C=C | C—H | H—H |
键能/ kJ·mol -1 | 347. 7 | 615 | 413. 4 | 436. 0 |
①乙烷直接裂解制乙烯的热化学方程式为_____________________________。
②氧化裂解制乙烯的热化学方程式为C2H6(g) + ![]() O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
(2)利用生物乙醇在某种分子筛催化下可脱水制取乙烯,相应反应如下:
I. C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
Ⅱ. 2C2H5OH(g) ![]() (C2H5)2O(g) + H2O(g)
(C2H5)2O(g) + H2O(g)
平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]及产品选择性如下图所示:

①反应 C2H5OH(g) ![]() C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
②关于上图中交点M,下列说法正确的是________(填字母)。
a. 一段时间内,反应I、Ⅱ的速率相等
b. 某温度下,反应I、Ⅱ的平衡常数相等
c. 一段时间内,反应I、Ⅱ中乙醇的转化率相等
(3)利用煤制合成气,再由合成气间接制乙烯包含的反应有:
I. CO(g) +2H2(g) ![]() CH3OH(g) △H=a kJ·mol-1
CH3OH(g) △H=a kJ·mol-1
Ⅱ. 2CH3QH(g) ![]() C2H4(g) + 2H2O(g) △H =b kJ·mol-1
C2H4(g) + 2H2O(g) △H =b kJ·mol-1
①反应 2CO(g) + 4H2(g) ![]() C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
②在容积为1 L的密闭容器中,投入2 mol CO和4 mol H2,10 min后,测得c(CO) = 1. 2 mol·L-1·min-1,则10 min内v(H2)=_____________ mol·L-1·min-1。