题目内容
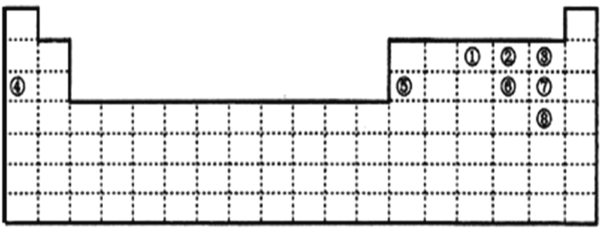
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
(1)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(2)写出④与⑥形成的化合物的形成过程____________________
(3)元素①的氢化物电子式为______________。
(4)④、⑤、⑥各自的最高价氧化物对应的水化物两两皆能反应,它们反应的离子方程式为____________,______________,_________________。
【答案】Al3+ HClO4 ![]()
![]() H++OH-=H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
H++OH-=H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
【解析】
根据各元素在周期表中的位置,推出①为N,②为O,③为F,④为Na,⑤为A,⑥为S,⑦为Cl,⑧为Br,据此分析;
(1)几种元素形成的简单离子分别是N3-、O2-、F-、Na+、Al3+、S2-、Cl-、Br-,其中简单离子半径最小的是Al3+;非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:F>O>Cl>Br>S,但F、O在高中阶段没有最高正价,因此最高价氧化物对应水化物的酸性最强的是HClO4;
(2)④和⑥形成的化合物是Na2S,Na2S属于离子化合物,即电子式表示的形成过程:![]() ;
;
(3)元素①的简单氢化物是NH3,其电子式为![]() ;
;
(4)三种元素的最高价氧化物对应水化物分别是NaOH、Al(OH)3、H2SO4,氢氧化铝是两性氢氧化物,因此反应的离子方程式为OH-+H+=H2O、Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目