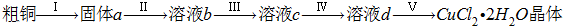题目内容
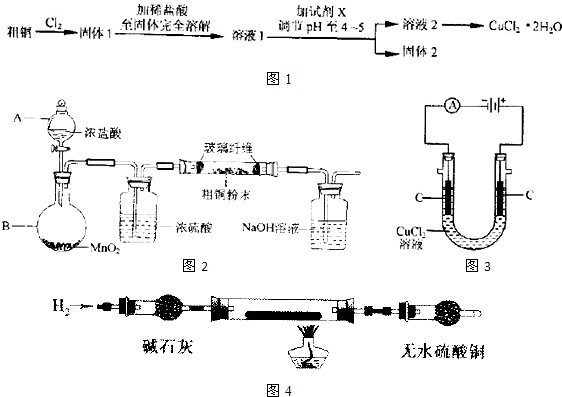
某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2?2H2O).

(1)步骤①中采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).

①仪器A的名称是
②连接好装置,然后进行的实验操作是
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
④虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)步骤②的具体操作是
(3)步骤③中试剂X用于调节pH以除去杂质,可选用下列试剂中的
a.NaOH b.NH3H2O c.Cu2(OH)2CO3 d.CuSO4
X发生反应的离子方程式是
(4)步骤④的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)
蓝色 黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.

(1)步骤①中采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).

①仪器A的名称是
分液漏斗
分液漏斗
;②连接好装置,然后进行的实验操作是
检验装置气密性
检验装置气密性
;③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
否
否
,理由是HCl不影响氯气和粗铜的反应的产物
HCl不影响氯气和粗铜的反应的产物
;④虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)步骤②的具体操作是
取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解
取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解
.(3)步骤③中试剂X用于调节pH以除去杂质,可选用下列试剂中的
c
c
(填序号).a.NaOH b.NH3H2O c.Cu2(OH)2CO3 d.CuSO4
X发生反应的离子方程式是
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
;得到固体2的操作名称是过滤
过滤
.(4)步骤④的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)
蓝色 黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)
abc
abc
.a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
分析:粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,步骤③目的是调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;实验室用二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,含有HCl、H2O等杂质,必须经过除杂,以此解答该题.
| ||
解答:解:(1)①仪器A是分液漏斗,故答案为:分液漏斗;
②制备气体,应首先检验装置的气密性,故答案为:检验装置气密性;
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl不影响氯气和粗铜的反应的产物;
④反应后尾气含有氯气,不能直接排放到空气中,应用NaOH溶液进行尾气的吸收,如图 ,故答案为:
,故答案为: ;
;
(2)步骤②为固体溶解的操作,操作方法为取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解,
故答案为:取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解;
(3)步骤③目的是调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,发生反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,从溶液中分离出固体,应用过滤的方法,
故答案为:c;Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;过滤;
(4)a.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故答案为:abc.
②制备气体,应首先检验装置的气密性,故答案为:检验装置气密性;
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl不影响氯气和粗铜的反应的产物;
④反应后尾气含有氯气,不能直接排放到空气中,应用NaOH溶液进行尾气的吸收,如图
 ,故答案为:
,故答案为: ;
;(2)步骤②为固体溶解的操作,操作方法为取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解,
故答案为:取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解;
(3)步骤③目的是调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,发生反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,从溶液中分离出固体,应用过滤的方法,
故答案为:c;Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;过滤;
(4)a.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故答案为:abc.
点评:本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目