题目内容
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义.
(1 )在反应:2SO2(g)+O2(g)?2SO3(g)的混合体系中,SO3的百分含量和温度的关系如图1(曲线上任何一点都表示平衡状态):
①2SO2(g)+O2(g)?2SO3(g)的△H 0 (填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气,平衡将 移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正 V逆(填“>”、“<”或“=).
(2 )①图2是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式 .
(△H用含Q1、Q2的代数式表示) ②25°C时,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,所得溶液的PH=7,则c ( NH+4) c (Cl-),a b,(填“>”、“<”或“=”);

(3)海水中含有大量以化合态形式存在的氯、碘元素.
已知:25℃时,Ksp[AgCl]=1.6×10-10 mol2?L-2、Ksp[AgI]=1.5×10-16mol2?L-2).在 25℃时,向 10mL0.002mol?l-1 的 NaCl 溶液中滴入 10mL0.002mol.l-1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴入O.1mol l-1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是 ,该反应的离子方程式 .
(1 )在反应:2SO2(g)+O2(g)?2SO3(g)的混合体系中,SO3的百分含量和温度的关系如图1(曲线上任何一点都表示平衡状态):
①2SO2(g)+O2(g)?2SO3(g)的△H
②当温度为T1,反应进行到状态D时,V正
(2 )①图2是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式
(△H用含Q1、Q2的代数式表示) ②25°C时,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,所得溶液的PH=7,则c ( NH+4)

(3)海水中含有大量以化合态形式存在的氯、碘元素.
已知:25℃时,Ksp[AgCl]=1.6×10-10 mol2?L-2、Ksp[AgI]=1.5×10-16mol2?L-2).在 25℃时,向 10mL0.002mol?l-1 的 NaCl 溶液中滴入 10mL0.002mol.l-1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴入O.1mol l-1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是
分析:(1)①由图1可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
②D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行;
(2)①由图2求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
②根据电荷守恒判断混合或溶液中c ( NH+4)、c (Cl-)的相对大小,溶液中存在平衡NH+4+H2O=NH3?H2O+OH-,据此解答;
(3)化学式所表示的阴阳离子个数比相同,溶度积越大,溶解性越大,物质由溶解度大的转化为溶解度更小的.
恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
②D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行;
(2)①由图2求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
②根据电荷守恒判断混合或溶液中c ( NH+4)、c (Cl-)的相对大小,溶液中存在平衡NH+4+H2O=NH3?H2O+OH-,据此解答;
(3)化学式所表示的阴阳离子个数比相同,溶度积越大,溶解性越大,物质由溶解度大的转化为溶解度更小的.
解答:解:(1))①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应,即△H<0;
恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动.
故答案为:<;向左;
②、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,
故答案为:>;
(2)①、由图可知,N2和H2反应生成1molNH3放出的热量为(Q2-Q1)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ?mol-1;
②、根据电荷守恒可知c(NH+4)+c(H+)=c(Cl-)+c(OH-),溶液pH=7,则c(H+)=c(OH-),故c(NH+4)=c(Cl-),
溶液中存在平衡NH+4+H2O=NH3?H2O+OH-,故氨水的浓度等于盐酸的浓度,即a>b,
故答案为:=,>;
(3)两者化学式所表示的阴阳离子个数比相同,溶度积越大,溶解性越大,即AgCl比AgI的溶解度大,物质由溶解度大的转化为溶解度更小的,所以由AgCl转化为更难溶的AgI,现象为白色沉淀转化为黄色沉淀,离子方程式为AgCl(s)+I-═AgI(s)+Cl-,
故答案为:Ksp(AgCl)>Ksp(AgI);AgCl(s)+I-═AgI(s)+Cl-.
恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动.
故答案为:<;向左;
②、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,
故答案为:>;
(2)①、由图可知,N2和H2反应生成1molNH3放出的热量为(Q2-Q1)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ?mol-1;
②、根据电荷守恒可知c(NH+4)+c(H+)=c(Cl-)+c(OH-),溶液pH=7,则c(H+)=c(OH-),故c(NH+4)=c(Cl-),
溶液中存在平衡NH+4+H2O=NH3?H2O+OH-,故氨水的浓度等于盐酸的浓度,即a>b,
故答案为:=,>;
(3)两者化学式所表示的阴阳离子个数比相同,溶度积越大,溶解性越大,即AgCl比AgI的溶解度大,物质由溶解度大的转化为溶解度更小的,所以由AgCl转化为更难溶的AgI,现象为白色沉淀转化为黄色沉淀,离子方程式为AgCl(s)+I-═AgI(s)+Cl-,
故答案为:Ksp(AgCl)>Ksp(AgI);AgCl(s)+I-═AgI(s)+Cl-.
点评:本题考查化学平衡、热化学方程式、沉淀转化及读图能力等,难度中等,(2)中用字母表示反应热数值,符号的确定容易忽略,为易错点.

练习册系列答案
相关题目
 合物的反应有重要意义.
合物的反应有重要意义.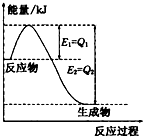 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.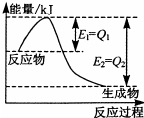 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义. 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
