题目内容
 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.(1)放热反应2SO2(g)+O2(g)=2SO3(g)是硫酸工业上的重要反应,在体积不变的条件下,下列措施有利于提高SO2平衡转化率的有
A、升高温度 B、降低温度 C、减小压强 D、加入催化剂 E.移出氧气
(2)氮是大气中含量最多的一种元素,氮及其化合物在工农业生产、生活中有着重要应用.用CH4将氮氧化物(用NOx表示)催化还原为N2可以消除氮氧化物带来的污染,该反应的化学方程式为
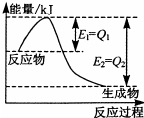
(3)如图是一定的温度和压强下,N2和H2反应生成1mol NH3过程中的能量变化图,请写出工业合成氨的热化学方程式
(4)在25℃下,将xmol/L的氨水与y mol/L的盐酸等体积混合,反应后溶液显中性,则c(NH4+ )
(5)已知:25℃时,Ksp(AgCl)=1.8×10-10、Ksp(AgBr)=4.9×10 -13.现在向0.001mol/L KBr和0.01mol/L KCl混合溶液中滴加0.1mol/L AgNO3溶液(反应过程中溶液体积变化忽略不计),当出现AgCl沉淀时.c(Br-)=
分析:(1)提高SO2平衡转化率,应使平衡向正反应方向移动,结合外界条件对平衡移动的影响判断;
(2)根据反应物和生成物确定反应的方程式;计算出x值,可列式计算物质的量之比;
(3)反应为放热反应,可根据活化能计算反应热;
(4)结合溶液的电荷守恒确定离子浓度大小关系,根据k=
计算电离平衡常数;
(5)根据溶度积计算.
(2)根据反应物和生成物确定反应的方程式;计算出x值,可列式计算物质的量之比;
(3)反应为放热反应,可根据活化能计算反应热;
(4)结合溶液的电荷守恒确定离子浓度大小关系,根据k=
| c(NH4+)×c(OH-) |
| c(NH3?H2O) |
(5)根据溶度积计算.
解答:解:(1)生成三氧化硫的反应为放热反应,则
A、升高温度,平衡逆向移动,转化率减小,故A错误;
B、降低温度,平衡正向移动,转化率增大,故B正确;
C、减小压强,平衡逆向移动,转化率减小,故C错误;
D、加入催化剂,平衡不移动,故D错误;
E.移出氧气,逆向移动,转化率减小,故E错误.
故答案为:B;
(2)CH4将氮氧化物(用NOx表示)催化还原为N2同时生成二氧化碳和水,反应的方程式为xCH4+4NOx
xCO2+2N2+2xH2O,
现有1L由NO、NO2组成的混合气体,若将其还原为N2、需同温同压下0.4LCH4,则x:4=0.4:1,可知x=1.6,故氮氧化物的分子式为NO1.6,
设NO为xmol,NO2为ymol,
则
=1.6,
解之得:x:y=2:3,
故答案为:xCH4+4NOx
xCO2+2N2+2xH2O;2:3;
(3)反应的方程式为N2(g)+3H2(g)?2NH3(g),正反应放热,由反应物与生成物总能量的关系可知反应热为△H=-2(Q2-Q1)kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ/mol;
(4)在25℃下,将xmol/L的氨水与y mol/L的盐酸等体积混合,反应后溶液显中性,因溶液中存在c(NH4+ )+c(H+)=c(Cl-)+c(OH-),则c(NH4+ )=c(OH-),反应后溶液中c(NH4+ )=c(Cl-)=
mol/L,c(OH-)=10-7mol/L,c(NH3?H2O)=
mol/L,
k=
=
=
,
故答案为:=;
;
(5)当出现AgCl沉淀时,c(Ag+)=
mol/L=1.8×10-8mol/L,则c(Br-)=
mol/L=2.7×10-5mol/L,
故答案为:2.7×10-5mol/L.
A、升高温度,平衡逆向移动,转化率减小,故A错误;
B、降低温度,平衡正向移动,转化率增大,故B正确;
C、减小压强,平衡逆向移动,转化率减小,故C错误;
D、加入催化剂,平衡不移动,故D错误;
E.移出氧气,逆向移动,转化率减小,故E错误.
故答案为:B;
(2)CH4将氮氧化物(用NOx表示)催化还原为N2同时生成二氧化碳和水,反应的方程式为xCH4+4NOx
| ||
现有1L由NO、NO2组成的混合气体,若将其还原为N2、需同温同压下0.4LCH4,则x:4=0.4:1,可知x=1.6,故氮氧化物的分子式为NO1.6,
设NO为xmol,NO2为ymol,
则
| x+2y |
| x+y |
解之得:x:y=2:3,
故答案为:xCH4+4NOx
| ||
(3)反应的方程式为N2(g)+3H2(g)?2NH3(g),正反应放热,由反应物与生成物总能量的关系可知反应热为△H=-2(Q2-Q1)kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(Q2-Q1)kJ/mol;
(4)在25℃下,将xmol/L的氨水与y mol/L的盐酸等体积混合,反应后溶液显中性,因溶液中存在c(NH4+ )+c(H+)=c(Cl-)+c(OH-),则c(NH4+ )=c(OH-),反应后溶液中c(NH4+ )=c(Cl-)=
| y |
| 2 |
| x-y |
| 2 |
k=
| c(NH4+)×c(OH-) |
| c(NH3?H2O) |
10-7×
| ||
|
| 10-7y |
| x-y |
故答案为:=;
| 10-7y |
| x-y |
(5)当出现AgCl沉淀时,c(Ag+)=
| 1.8×10-10 |
| 0.01 |
| 4.9×10 -13 |
| 1.8×10-8 |
故答案为:2.7×10-5mol/L.
点评:本题考查较为综合,涉及知识面广,综合考查学生的分析能力和计算能力,为高考常见题型和高频考点,注意把握相关计算公式的运用,难度中等.

练习册系列答案
相关题目

 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.