题目内容
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
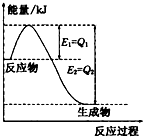
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):
N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ?mol-1
(2)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
| ||
| (一定条件) |
阳
阳
极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性.求25℃下该混合溶液中氨水的电离平衡常数
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
(4)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在.在25℃下,向0.1L0.002mol?L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol?L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是
c(Ag+)?c(Cl-)>Ksp(AgCl)
c(Ag+)?c(Cl-)>Ksp(AgCl)
,向反应后的浑浊液中继续加入0.1L0.002mol?L-1的NaI溶液,看到的现象是白色沉淀转化为黄色沉淀
白色沉淀转化为黄色沉淀
,产生该现象的原因是(用离子方程式表示)AgCl(s)+I-(aq)═AgI(s)+Cl-(aq)
AgCl(s)+I-(aq)═AgI(s)+Cl-(aq)
.分析:(1)由图求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
(2)在电解池中,阳极上发生失电子的氧化反应,阴极上发生得电子的还原反应,根据电解的总反应来书写电极反应;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
计算;
(4)根据Qc与Ksp的相对大小来确定有没有沉淀产生,溶解度越小越易形成沉淀.
(2)在电解池中,阳极上发生失电子的氧化反应,阴极上发生得电子的还原反应,根据电解的总反应来书写电极反应;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
| c(NH4+)×c(OH-) |
| c(NH3?H2O) |
(4)根据Qc与Ksp的相对大小来确定有没有沉淀产生,溶解度越小越易形成沉淀.
解答:解:(1)由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q1-Q2)kJ?mol-1,
故答案为:N2 (g)+3H2(g)═2NH3(g)△H=2(Q1-Q2) kJ?mol-1;
(2)跟据总反应式:N2+3H2 ?2NH3,氢气发生失电子的氧化反应,则在电解法合成氨的过程中,应将H2不断地通入阳极,在另一电极通入N2,发生得电子的还原反应,即N2+6H++6e-=2NH3;
故答案为:阳;N2+6H++6e-=2NH3;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
mol/L,混合后反应前c(NH3?H2O)=
mol/L,则反应后c(NH3?H2O)=(
-
)mol/L,
则k=
=
=
,
故答案为:
;
(4)解答:Qc=c(Ag+).c(Cl-)=0.001mol?L-l×0.001mol?L-l=10-6>Ksp(AgCl),所以有沉淀,KSP(AgCl)>KSP(AgI)沉淀转化,所以AgCl会转化为AgI,白色沉淀转化为黄色沉淀,离子反应为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:c(Ag+).c(Cl-)>Ksp(AgCl);白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
故答案为:N2 (g)+3H2(g)═2NH3(g)△H=2(Q1-Q2) kJ?mol-1;
(2)跟据总反应式:N2+3H2 ?2NH3,氢气发生失电子的氧化反应,则在电解法合成氨的过程中,应将H2不断地通入阳极,在另一电极通入N2,发生得电子的还原反应,即N2+6H++6e-=2NH3;
故答案为:阳;N2+6H++6e-=2NH3;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
则k=
| c(NH4+)×c(OH-) |
| c(NH3?H2O) |
| ||||
|
| b×10-7 |
| a-b |
故答案为:
| b×10-7 |
| a-b |
(4)解答:Qc=c(Ag+).c(Cl-)=0.001mol?L-l×0.001mol?L-l=10-6>Ksp(AgCl),所以有沉淀,KSP(AgCl)>KSP(AgI)沉淀转化,所以AgCl会转化为AgI,白色沉淀转化为黄色沉淀,离子反应为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:c(Ag+).c(Cl-)>Ksp(AgCl);白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
点评:本题考查了热化学方程式书写,电解原理的应用电解反应的书写方法,弱电解质电离平衡的计算应用,沉淀溶解平衡的分析判断,题目难度中等.

练习册系列答案
相关题目