题目内容
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
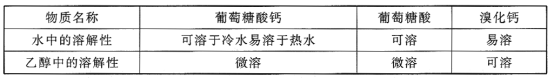
相关物质的溶解性见下表:
实验流程如下:

回答下列问题:
(1)第①步中溴水氧化葡萄糖时,甲同学设计了如图所示装置。
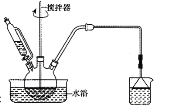
①你认为缺少的仪器是__。
②甲同学在尾气吸收装置中使用倒立漏斗的目的是__。
(2)第②步CaCO3固体过量,其目的是__。
(3)本实验中___(填“能”或“不能”)用CaCl2替代CaCO3,理由是__。
(4)第③步“某种操作”名称是__。
(5)第④步加入乙醇的作用是__。
(6)第⑥步中洗涤操作主要是除去沉淀表面可能含有的溴化钙,洗涤剂最合适的是__(填标号)。
A.冷水 B.热水 C.乙醇 D.乙醇—水混合溶液
【答案】温度计 防止倒吸 使葡萄糖酸充分反应,提高葡萄糖酸的转化率 不能 氯化钙与葡萄糖酸不反应 趁热过滤 降低葡萄糖酸钙的溶解度,有利于其析出 D
【解析】
葡萄糖中加入3%的溴水并且加热,发生反应C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr,得到葡萄糖酸和HBr,加入过量碳酸钙并加热,发生反应2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2Ca(葡萄糖酸钙)+H2O+CO2、CaCO3+2HBr=CaBr2+CO2↑+H2O,趁热过滤,然后加入乙醇得到葡萄糖酸钙悬浊液,过滤、洗涤、干燥得到葡萄糖酸钙,据此进行分析。
(1)①根据流程可知溴水氧化葡萄糖时需要控制温度为55℃,所以还需要温度计;
②倒置的漏斗可以起到防止倒吸的作用;
(2)CaCO3固体需有剩余,可使葡萄糖酸充分反应,提高葡萄糖酸的转化率,符合强酸制弱酸原理,以确保葡萄糖酸完全转化为钙盐;
(3)盐酸为强酸,酸性比葡萄糖酸强,氯化钙不能与葡萄糖酸直接反应得到葡萄糖酸钙,所以不宜用CaCl2替代CaCO3;
(4)根据表格中葡萄糖酸钙的溶解度与温度可知葡萄糖酸钙冷却后会结晶析出,应趁热过滤;
(5)葡萄糖酸钙在乙醇中的溶解度是微溶,可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出;
(6)利用水可以将无机杂质溶解除掉,同时利用葡萄糖酸钙在乙醇中的微溶,减少葡萄糖酸钙的损失,所以应选“乙醇—水的混合溶液”进行洗涤。

 名校课堂系列答案
名校课堂系列答案