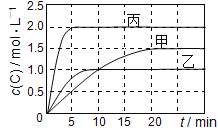
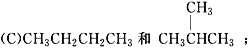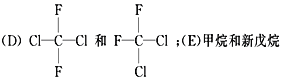题目内容
【题目】在如图所示的实验装置中,当A、B、C、分别为以下不同组合的物质时,回答有关问题:
(1).当A为醋酸、B为石灰石、C为苯酚钠溶液时,小试管中的现象是__________________________,小试管中发生反应的化学方程式是___________________________________________。整个实验可得出的结论是_______________________。
(2).当A为饱和食盐水、B为电石、C为酸性KMnO4溶液时,小试管中的现象是______________;A和B反应的方程式是____________________________。
(3).装置中D部分的作用是____________________________。
【答案】 溶液变浑浊 C6H5ONa+CO2+H2O==C6H5OH+NaHCO3。(注:换成苯环表示。) 碳酸的酸性强于苯酚 .酸性高锰酸钾溶液褪色 CaC2 +2H2O == C2H2 ↑ + Ca(OH)2 防止倒吸。
【解析】试题分析:(1).当A为醋酸、B为石灰石,烧瓶中生成二氧化碳气体;二氧化碳通入为苯酚钠溶液时生成微溶性的苯酚;根据强酸制弱酸分析结论。
(2). A为饱和食盐水、B为电石,烧瓶中生成乙炔气体;乙炔通入酸性KMnO4溶液时,乙炔被酸性高锰酸钾氧化。
(3). D容积较大,可防止防止倒吸。
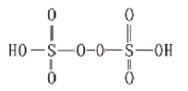
解析:(1).当A为醋酸、B为石灰石,烧瓶中醋酸与碳酸钙反应生成醋酸钙、二氧化碳。水;二氧化碳通入为苯酚钠溶液时生成微溶性的苯酚和碳酸氢钠,小试管中的现象是溶液变浑浊,方程式为![]() ;二氧化碳通入为苯酚钠溶液时生成微溶性的苯酚,说明碳酸酸性大于苯酚。
;二氧化碳通入为苯酚钠溶液时生成微溶性的苯酚,说明碳酸酸性大于苯酚。
(2). A为饱和食盐水、B为电石,烧瓶中生成乙炔气体;乙炔通入酸性KMnO4溶液时,乙炔被酸性高锰酸钾氧化,小试管中的现象是酸性高锰酸钾溶液褪色;水和碳化钙反应生成乙炔和氢氧化钙的方程式是CaC2 +2H2O == ![]() ↑ + Ca(OH)2。
↑ + Ca(OH)2。
(3) D容积较大,可防止防止倒吸。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】短周期非金属元素甲~丁在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 |
A. 原子半径:甲<乙
B. 原子最外层电子数:甲>丁
C. 原子核外电子层数:丙>甲
D. 元素的最高价氧化物对应水化物的酸性:丁<丙