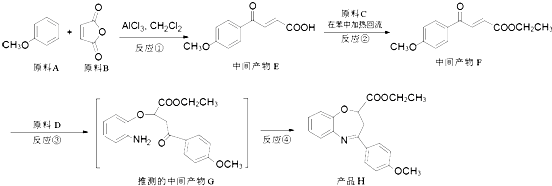
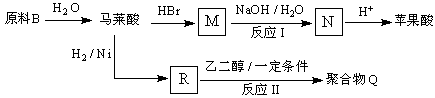
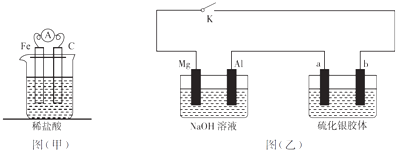
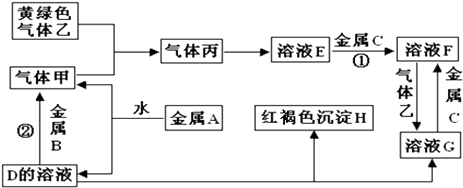
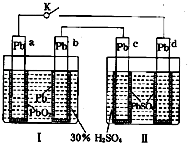
��Ŀ����
����Ŀ��X��Y��Z��Q��E����Ԫ���У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�Ӻ����L���������K���������Z�ǵؿ��ں�����������������ߵ�Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ش��������⣺
��1��X��ԭ�ӽṹʾ��ͼΪ��Y�ļ۵��ӹ����ʾʽΪ ��
��2��XZ2��YZ2���ӵ�����ṹ�ֱ����� �� ��ͬ������������ˮ�е��ܽ�Ƚϴ������д����ʽ���������� ��
��3��Q��Ԫ�ط����� �� �����ڵ������壬���ĺ�������Ų�ʽΪ �� ���γɻ�����ʱ��������ϼ�Ϊ
��4���������ʾʽд��E���⻯��ˮ��Һ�д��ڵ�������� ��
���𰸡�
��1��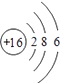 ��
��![]()
��2��V�Σ�ֱ���Σ�SO2��SO2�Ǽ��Է��ӣ�H2OҲ�Ǽ��Է��ӣ��������ܣ���CO2�ǷǼ��Է���
��3��Cr���ģ���B��1s22s22p63s23p63d54s1��+6
��4��F��H��F��F��H��O��O��H��F��O��H��O
���������⣺Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���������Ų�ӦΪ1s22s22p63s23p4 �� ΪSԪ�أ�Yԭ�Ӻ����L���������K���������Y��2�����Ӳ㣬����������Ϊ4����YΪCԪ�أ�Z�ǵؿ��ں�����ߵ�Ԫ�أ�ΪOԪ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�ԭ������Ϊ24��ΪCrԪ�أ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�����ӦΪFԪ�أ���1�������Ϸ�����֪��XΪS����ԭ�ӽṹʾ��ͼΪΪ 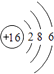 ��YΪC���۵����Ų�Ϊ2s22p2 �� �۵��ӹ����ʾΪ
��YΪC���۵����Ų�Ϊ2s22p2 �� �۵��ӹ����ʾΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� 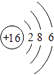 ��
�� ![]() ����2��SO2�У�S��O�γ�2���ļ�����1���µ��Ӷԣ�ΪV�Σ�CO2�У�C��O�γ�2���ļ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2OҲ�Ǽ��Է��ӣ��������ܣ���CO2�ǷǼ��Է��ӣ���SO2��ˮ���ܽ�ȸ���
����2��SO2�У�S��O�γ�2���ļ�����1���µ��Ӷԣ�ΪV�Σ�CO2�У�C��O�γ�2���ļ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2OҲ�Ǽ��Է��ӣ��������ܣ���CO2�ǷǼ��Է��ӣ���SO2��ˮ���ܽ�ȸ���
���Դ��ǣ�V�Σ�ֱ���Σ�SO2��SO2�Ǽ��Է��ӣ�H2OҲ�Ǽ��Է��ӣ��������ܣ���CO2�ǷǼ��Է��ӣ���3��QΪCr��ԭ������Ϊ24��λ�����ڱ��������ڢ�B�壬��������Ų�ʽΪ1s22s22p63s23p63d54s1 �� ����ϼ�Ϊ+6�ۣ�
���Դ��ǣ�Cr���ģ���B��1s22s22p63s23p63d54s1��+6����4��HF��ˮ��Һ�У�F�ĵ縺�Խϴ�����һ���ӵ�HF��ˮ�е�H�γ�������ɱ�ʾΪH��F��H����ԭ�Ӻͷ���������е���ԭ��֮�����γ�������ɱ�ʾΪ F��H��O����ԭ�Ӻ�ˮ�����е���ԭ�����γ�����ɱ�ʾΪO��H��F����ԭ�Ӻ���һ��ˮ�����е���ԭ�����γ�����ɱ�ʾΪO��H��O��
���Դ��ǣ�F��H��F��F��H��O��O��H��F��O��H��O��