题目内容
【题目】水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)在100℃下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______________。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积约为_____________。
【答案】1×10-14 1×10-12 2:9 0.004
【解析】
根据水的离子积常数分析计算。
(1)A点纯水中c(H+)= c(OH-)=10﹣7mol/L,Kw =c(H+)c(OH-)=10﹣14 ,温度升为100℃,B点纯水中c(H+)= c(OH-)=10﹣6mol/L,Kw = c(H+)c(OH-)=10﹣12 ;
(2)在100℃下,pH=8的Ba(OH)2溶液中C(OH-)=10﹣4mol/L,pH=5的稀盐酸中c(H+)=10﹣5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,在100℃条件下,混合溶液pH=7,溶液呈碱性,混合溶液中c(OH-)=10﹣5 mol/L,故c(OH-)=![]() =10﹣5 mol/L,所以x:y=2:9。
=10﹣5 mol/L,所以x:y=2:9。
(3)该温度下Ca(OH)2的溶解度为0.74g,,则100g水中溶解0.74gCa(OH)2时Ca(OH)2的c=![]()
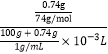 ≈0.1mol/L,故c(OH-)=2 c[Ca(OH)2]=0.2mol/L,离子积=[c(Am+)]n[c(Bn﹣)]m=c(Ca2+ )·c2(OH-)=0.1mol/L×(0.2mol/L)2=4×10﹣3(mol/L)3
≈0.1mol/L,故c(OH-)=2 c[Ca(OH)2]=0.2mol/L,离子积=[c(Am+)]n[c(Bn﹣)]m=c(Ca2+ )·c2(OH-)=0.1mol/L×(0.2mol/L)2=4×10﹣3(mol/L)3

【题目】下列实验操作、现象与对应的结论或解释正确的是
选项 | 操作 | 现象 | 结论或解释 |
A | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰吴黄色 | 原溶液中有 |
B | 将 | 溶液紫色褪去 |
|
C | 向 | 得到澄清溶液 |
|
D | 向盛有少量溴水的分液漏斗中加入裂化汽油,充分振荡,静置 | 上、下层液体均近无色 | 裂化汽油不可用作溴的萃取溶剂 |
A. AB. BC. CD. D
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D