题目内容
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
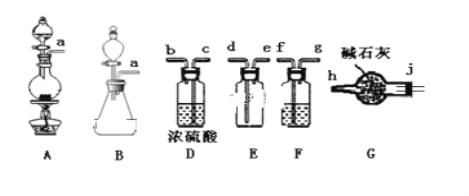
①制备NO发生装置可以选用___________________(填写字母代号),请写出发生反应的离子方程式:___________________。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ __________________(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
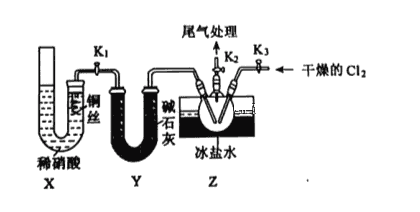
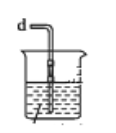
①实验室也可用X装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
【答案】B 3Cu+8H++NO3-=3Cu2++2NO↑+4H2O f→g→c→ b→d→e→j→h 排除装置内空气的干扰,可以随开随用,随关随停 K3 排干净三颈瓶中的空气,防NO和NOCl变质 2NOCl+H2O=2HCl+NO↑+NO2↑ NaOH 14.7375c/m×100%
【解析】
(1)①制备NO,常用Cu和稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,因此选用的装置为B,反应离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②a装置为制备Cl2装置,制备的氯气中混有HCl和水蒸气,先通过饱和食盐水除去HCl,然后通过浓硫酸,氯气的密度大于空气的密度,收集时从d管通入,氯气有毒,必须尾气处理,连接顺序是a→f→g→c→ b→d→e→j→h;
(2)①装置X的优点是排除装置内空气的干扰,可以随开随用,随关随停;
②NO与O2能发生反应,先通入一段时间的气体,排除三颈烧瓶中的空气,防止NO和NOCl变质,即打开K2后,然后打开K3;
③装置Y的作用是干燥NO,NOCl能与水反应,因此无装置Y,则NOCl与水发生反应,根据信息,反应方程式为2NOCl+H2O=2HCl+NO↑+NO2↑;
④尾气中含有HCl、Cl2、NO、NO2,HCl和Cl2能与NaOH发生反应,被除去,NO+NO2+2NaOH=2NaNO2+H2O,因此烧杯中可加入NaOH溶液;
(3)K2CrO4为指示剂,根据溶度积大小,Ag+先于Cl-反应生成AgCl,建立关系式:NOCl~HCl~AgNO3,NOCl的质量分数为![]() ×100%=14.7375c/m×100%。
×100%=14.7375c/m×100%。

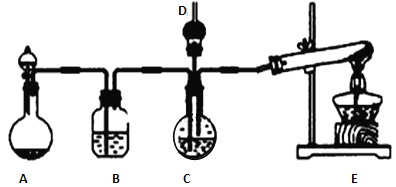
【题目】利用下图装置可以进行实验并能达到实验目的的是
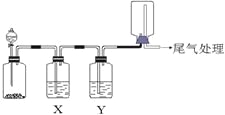
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D