��Ŀ����
����Ŀ����̼���⡢������Ԫ����ɵ�ij�л�������й�����10��ԭ�ӣ���ԭ��
�����32�����ӣ�lmol���л�������������ȫȼ��ʱ��Ҫ4molO2���ش�
(1)����л���ķ���ʽ��
(2)�����л����ʹ��ˮ��ɫ����������������Ӧ��ȡ2mol���л����������Ʒ�Ӧ��
�ܲ���22.4L H2(��״��)������л���Ľṹ��ʽ������ʲô?
(3)�����л����ܷ���������Ӧ������ṹ��ʽ��ʲô? ��д�����л����������Ӧ�Ļ�ѧ����ʽ��
���𰸡�(1) C3H6O (2) CH��CH��CH2OH (3) CH3CH2CHO
CH3CH2CHO + 2Ag(NH3)2OH![]() CH3CH2COONH4+ 2Ag + 3NH3+ H2O
CH3CH2COONH4+ 2Ag + 3NH3+ H2O
�����������������(1)����л���ķ���ʽΪCxHyOz����Ϊ�����й�����10��ԭ�ӣ�����x+y+z=10����ԭ��,�����32�����ӣ���6x+y+8z=32��lmol���л�������������ȫȼ��ʱ��Ҫ4molO2����x+y/4-z/2=4�������õ���
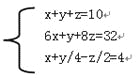 ��
��
��ã�x=3��y=6��z=1�����Ը��л���ķ���ʽΪ��C3H6O��
(2)�����л����ʹ��ˮ��ɫ����������������Ӧ�����л���ķ���ʽΪ��C3H6O���䲻���Ͷ�Ϊ1�����Ը��л��ﺬ��̼̼˫����2mol���л����������Ʒ�Ӧ���ܲ���22.4L H2(��״��)��˵�����л��ﺬ���ǻ����ʸ��л���Ľṹ��ʽ����ΪCH��CH��CH2OH�����ǻ�����������˫���ϵ�̼�������Ľṹ���ȶ�����(3)�����л����ܷ���������Ӧ������л��ﺬ��ȩ����������ṹ��ʽΪ��CH3CH2CHO���䷢��������Ӧ�Ļ�ѧ����Ϊ��
CH3CH2CHO + 2Ag(NH3)2OH![]() CH3CH2COONH4+ 2Ag + 3NH3+ H2O��
CH3CH2COONH4+ 2Ag + 3NH3+ H2O��




