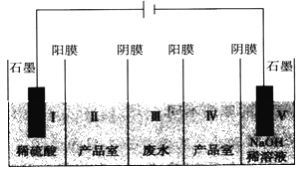
题目内容
【题目】按要求回答下列问题:
(1)反应Cl2+H2OH++Cl-+HC1O其化学平衡常数的K表达式为:_________
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈______(填“弱酸性”、“中性”或“弱碱性”).
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应______;
H2SO4溶液与Na2SO4溶液反应______.
③在0.1molL-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______.(填编号)
A.c(SO42-)+c(HSO4-)=0.1molL-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
【答案】  CD 弱碱性 SO42-+H2OOH-+HSO4- HSO4-+Ba2+=BaSO4↓+H+;H++SO42-=HSO4- AC
CD 弱碱性 SO42-+H2OOH-+HSO4- HSO4-+Ba2+=BaSO4↓+H+;H++SO42-=HSO4- AC
【解析】(1)平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值;正确答案:![]() ;
;
(2) 0.1mol/L醋酸溶液中加水稀释后,平衡右移,醋酸的电离程度增大,n(CH3COOH)减少, n(CH3COO-)增大 ,n(H+)增大,但是c(CH3COOH)、c(CH3COO-)、 c(H+)都减少,根据KW= c(H+)c(OH-)=10-14, c(OH-)增大;A.n(CH3COO-)、n(H+)都增大,答案A错 误;B.加水稀释,醋酸的电离程度增大,c(H+)减少,B错 误;C. 公式上下同乘以c(H+)得到以下式子: ![]() K只与温度有关,温度不变,K不变,为常数;C正确;D.醋酸加水稀释,溶液中c(H+)= c(H+)水+ c(H+)醋酸,所以
K只与温度有关,温度不变,K不变,为常数;C正确;D.醋酸加水稀释,溶液中c(H+)= c(H+)水+ c(H+)醋酸,所以 减小,D正确;正确答案:CD;
减小,D正确;正确答案:CD;
(3)①根据题意,Na2SO4为强碱弱酸盐,水解显碱性,SO42-+H2OOH-+HSO4- ;正确答案:溶液呈弱碱性。
②弱酸根HSO4-和Ba2+反应生成BaSO4沉淀;正确答案: HSO4-+Ba2+=BaSO4↓+H+;硫酸钠为弱酸强碱盐,硫酸为强酸,二者反应生成硫酸氢钠;正确答案:SO42-+H+=HSO4- ;
③A.c(SO42-)+c(HSO4-)=0.1molL-1 ,物料守恒,A正确;
B.2c(SO42-)+2c(HSO4-)=c(Na+),B错误;
C.c(OH-)=c(H+)+c(HSO4-),质子守恒,C正确;
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),D错误。